|
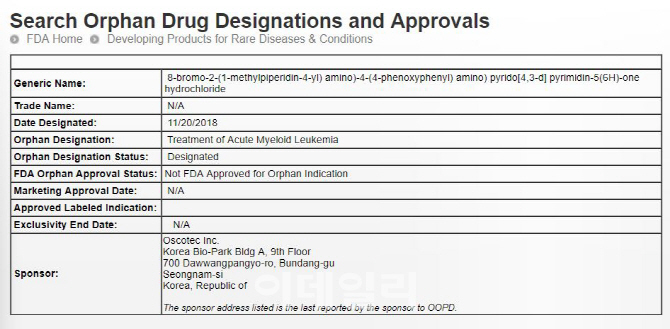
오스코텍은 미국 식품의약국(FDA)이 자사의 급성 골수성 백혈병치료제 ‘SKI-G801’을 희귀의약품으로 지정했다고 22일 밝혔다. SKI-G801는 급성 골수성 백혈병을 유발하는 대표적인 유전자인 ‘FLT3’ 돌연변이를 억제해 기존 약의 내성을 극복할 수 있는 차세대 신약후보물질이다. 미국에서 전임상(동물실험)을 마치고 지난해 12월부터 미국 5개 기관에서 임상 1상을 진행 중이다.
만성골수성백혈병은 ‘글리벡’이라는 표적치료제가 등장한 이후 10년 이상 생존율이 80~90%에 달하는 상황이다. 하지만 급성골수성백혈병은 현재 완벽한 치료제가 없는 실정이다. 같은 계열(FLT3 저해제)에서 이미 상용화한 제품은 스위스 노바티스의 ‘PKC-412’가 있고, 일본 다케다의 TAK-659 등이 임상을 진행 중이다. 하지만 오스코텍이 개발 중인 SKI-G801은 동물실험에서 효과가 기존 제품보다 오래 유지되는 것으로 확인됐다. ‘계열 내 최고’(베스트인클래스) 의약품 출시를 노릴 수 있는 위치에 있는 것이다.
이에 FDA가 이번에 SKI-G801의 희귀의약품 지정을 승인한 것으로 풀이된다. FDA는 지난 1983년 제정한 ‘희귀의약품법’에 따라 희귀난치성 질병이나 생명을 위협하는 질병을 치료하는 약의 경우 희귀의약품으로 지정한다. 환자 수가 20만명을 넘지 않거나, 이를 넘더라도 시장성이 없어 개발을 꺼리는 질환을 대상으로 한다. FDA가 희귀의약품으로 지정하면 △7년간 독점권 인정 △개발비 세액공제 △품목허가 신청 시 수수료 면제 등의 혜택이 있다. 일반적인 신약(5년)보다 독점 기간이 길고 허가 과정에서 각종 경제적 혜택을 받을 수 있는 것이다. 생명공학정책연구원에 따르면 2014년 970억달러였던 전 세계 희귀의약품 시장은 오는 2022년 2090억달러까지 성장할 전망이다.
이번 희귀의약품 지정에 따라 SKI-G801은 향후 상업화에도 속도를 낼 것으로 기대된다. 현재 진행 중인 임상과 더불어 글로벌 제약사들과 기술이전에 대한 협의도 진행 중이다. 김중호 오스코텍 전무는 “SKI-G801이 약효를 확인하고 기술적으로 인정을 받았기 때문에 FDA로부터 희귀의약품 지정을 받은 것”이라며 “희귀의약품 지정에 따른 혜택이 기대된다”고 말했다.
한편 급성백혈병 치료제의 전 세계 시장은 2015년 약 4억 5000만달러 규모에서 연평균 17.32% 성장, 오는 2020년에는 10억달러 시장을 형성할 것으로 관측된다.
|