|
iDMC는 무작위, 이중맹검(double-blind) 등으로 진행되는 임상에서 안전성 및 과학적 타당성을 확보하기 위한 목적으로 운영하는 독립위원회다. iDMC는 주로 임상 3상 시험 단계에서 열린다. 이중맹검으로 신약 임상시험을 하는 기업은 필수로 거쳐야 한다. 지놈앤컴퍼니의 경우 아직 임상 2상 단계고 이중맹검으로 임상을 진행하고 있지 않지만, 임상 결과에 대한 공신력 있는 의견을 받기 위해 iDMC를 소집한 것으로 알려졌다. 임상 결과에 자신있다는 의미로도 해석할 수 있는 부분이다.
배지수 지놈앤컴퍼니 대표는 “만약 개발 중인 후보물질이 약효가 없다면 환자들을 모집하고 투여하는 건 윤리적으로 어긋나기 때문에 위원회를 열어 이 부분을 명확히 하고자 한다”며 “나아가 임상 결과가 좋다면 보다 공신력 있는 메시지를 투자자들에게 줄 수 있을 것”이라고 설명했다.
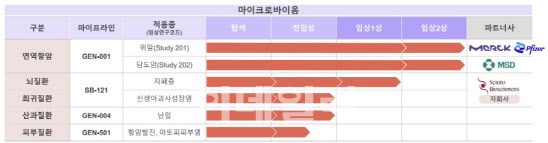
이번 중간 결과는 42명 임상 대상자 중 21명에 대한 임상 결과이며, 임상 지속이 나오면 회사는 나머지 21명 환자 모집을 올해 안으로 마칠 예정이다. 투약 후 경과 관찰 시간 등을 고려하면 최종 결과는 내년 하반기 쯤 나올 전망이다. GEN-001은 건강한 사람에서 분리한 락토코커스 락티스 단일 균주다. 독일 머크·화이자의 바벤시오와 병용으로 임상을 진행 중이다. 이밖에도 미국 머크(MSD)의 키트루다와 담도암을 대상으로 한 임상 2상도 진행 중이다. 담도암 임상의 경우 우 현재 식약처에 임상시험계획(IND) 변경승인신청 중이며 하반기 첫 환자 투약을 앞두고 있다.
지놈앤컴퍼니는 이번 임상 2상 중간 결과에서 긍정적인 유효성 데이터를 확인할 경우 독일 머크에 기술수출할 가능성도 커질 것으로 전망하고 있다. 머크와 후기 임상 계획 등에 대해 현재 긴밀히 논의하고 있다는 게 회사 측 설명이다.
배 대표는 “향후 대조군과의 비교 임상을 추가로 할 예정”이라며 “2상을 마친 뒤 후기 임상 개념으로 하거나 임상 3상에 바로 들어갈 수도 있다. 후기 임상과 3상을 엮어서 가는 방법도 있다. 추가적인 임상 방향은 머크와 긴밀하게 논의할 부분”이라고 말했다.
한편 최근 마이크로바이옴 신약이 잇달아 FDA 승인을 획득하면서 후발주자들 제품에 대한 상용화 기대감이 커지고 있다. FDA는 지난해 11월 스위스 기업 페링제약(Ferring Pharmaceuticals)이 설사와 장염을 유발하는 CDI(Clostridium difficile infection, 클로스트리디움 디피실 감염증) 적응증을 대상으로 한 마이크로바이옴 치료제를 승인했다. 지난 26일(현지시간)에는 최초의 경구용 마이크로바이옴 치료제를 승인했다. 세레스 테라퓨틱스(Seres Therapeutics)가 개발한 경구용 분변 미생물 제품인 ‘보우스트(Vowst)’로, CDI에 대한 항생제 치료 이후 CDI 재발 예방 용도로 발매가 허가됐다.

![[일문일답]교육부 의대증원 32개大 중 12곳 학칙개정 완료](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24050800840t.jpg)



