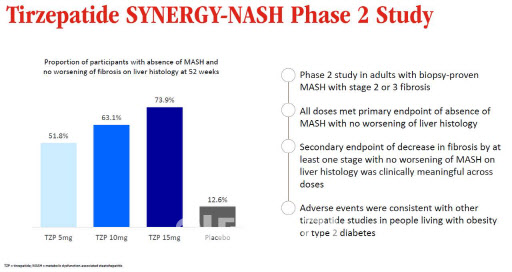
◇GLP-1 제재, MASH 치료에도 유효성 보여
일라이 릴리는 6일(현지시간) 티르제파타이드가 MASH 임상 2상에서 1차평가변수를 충족했다고 밝혔다. MASH 환자 대상으로 진행한 임상 2상에서 52주차에 섬유화 악화 없이 증상을 개선한 피험자가 73.9%로 나타났다. 위약군이 12.6%인 점을 고려하면 상당히 높은 수치다.
|
국내 바이오기업이 개발 중인 GLP-1 계열 MASH 신약에도 투자자들의 관심이 쏠릴 것으로 전망된다. 현재 GLP-1 계열 MASH 신약을 보유한 국내 바이오기업으로는 한미약품(128940), 동아에스티(170900) 자회사 뉴로보 파마슈티컬스(이하 뉴로보), 디앤디파마텍 등이 있다.
◇한미약품, 임상 2b상 단계 GLP-1 계열 MASH 신약 2개 보유
한미약품은 국내 제약·바이오 기업 중 가장 개발 단계가 앞선 GLP-1 계열 MASH 신약 파이프라인을 보유하고 있다. 한미약품의 에피노페그듀타이드(HM12525A·MK-6024)와 에포시페그트루타이드(HM15211)는 모두 글로벌 임상 2b상을 진행 중이다.
에피노페그듀타이드는 2020년 미국 머크(MSD)에 최대 8억6000만달러(한화 약 1조1500억원)에 기술이전됐다. 머크는 지난해 6월 에피노페그듀타이드 글로벌 임상 2b상을 개시했다. 내년 12월에 임상을 종료하는 것을 목표로 300명의 피험자를 모집하며 임상을 진행 중이다.
에포시페그트루타이드는 한미약품이 자체적으로 개발 중이며, 미국과 한국에서 임상 2b상을 추진하고 있다. 한미약품은 해당 임상을 내년 11월에 마칠 예정이다. 이후 임상 3상을 직접 진행할지, 기술이전할지에 대해서는 다방면으로 검토하고 있다.
◇뉴로보, 연내 ‘DA-1241’ 글로벌 임상 2a상 톱라인 도출
뉴로보는 지난해 5월 MASH·2형 당뇨 치료제 ‘DA-1241’의 임상시험계획(IND) 승인을 받고 글로벌 임상 2a상을 진행 중이다. 올해 3분기까지 임상 2a상의 환자 모집을 마치고 4분기에는 톱라인 결과를 확인할 예정이다.
해당 임상은 단독 요법인 파트1과 당뇨 치료제 ‘시타글립틴(Sitagliptin)’ 병용 요법인 파트2로 나눠서 진행된다. 파트1은 지난해 9월 환자 투약을 시작했으며, DA-1241의 단독 효능과 안전성을 확인하기 위한 임상이다. 지난달 개시한 파트2는 시타글립틴 병용 투여의 효능과 안전성을 확인하기 위해 MASH 환자 37명을 대상으로 16주간 다기관, 무작위 배정, 이중 눈가림, 위약 대조, 평행 비교 방식으로 진행된다.
김형헌 뉴로보 대표는 “DA-1241과 시타글립틴의 병용 투여 전임상에서 효과적이고 안전한 MASH 치료제의 가능성을 확인했다”며 “DA-1241 글로벌 임상 2상을 순조롭게 진행해 2024년 하반기 성공적인 임상 데이터를 도출해 내겠다”고 말했다.
◇디앤디파마텍, 中 기술수출한 ‘DD01’ MASH 임상은 자체 진행
디앤디파마텍은 GLP-1 계열 펩타이드 약물 개발사로 지난해 대사성 질환 치료 중심으로 파이프라인을 재정비했다.
디앤디파마텍의 MASH 치료제 ‘DD01’은 지난해 1분기에 미국 임상 1상을 완료했다. 2021년 9월에는 중국 선전 살루브리스 제약(Shenzhen Salubris Pharmaceuticals)에 1억9200만달러(한화 약 2500억원) 규모에 DD01의 중국 지역 권리를 넘기는 기술이전 계약을 체결했다.
중국 파트너사는 DD01을 MASH 치료제로 기술도입했지만 비만 치료제로 개발하기로 결정했다. 연내 중국에서 비만 임상 1상이 개시될 예정이다. 미국 등 나머지 지역 임상 2상은 디앤디파마텍이 자체적으로 진행한다. 디앤디파마텍은 올해 상반기내 DD01의 MASH 임상 2상을 미국에서 추진할 계획이다.
또 다른 MASH 치료제로는 비만·MASH 치료제인 ‘DD03’이 있다. DD03은 지난해 4월 미국 멧세라(Metsera, Inc.)에 기술이전돼 선도물질 평가연구를 진행 중이다. 회사측은 “DD03의 경우 아직 개발 초기 단계이기 때문에 임상 진입 시점을 예단하기는 어렵다”고 언급했다.
한편 곧 세계 최초로 FDA에서 허가 받은 MASH 신약이 탄생할 전망이다. 마드리갈 파마슈티컬스(Madrigal Pharmaceuticals)의 경구용 갑상선호르몬수용체(THR)-β 작용제 ‘레스메티롬(resmetirom)’는 내달 14일 FDA의 우선심사 결과 발표를 앞두고 있다. 업계에서는 첫 MASH 치료제 허가 획득 시 후속으로 개발 중인 MASH 신약에 대한 투자자들의 관심도 동반 상승할 것으로 기대하고 있다.
이동건 SK증권 연구원은 “올해 1분기 첫 MASH 치료제의 허가 획득 시 그간 미충족 수요(unmet needs)가 높았던 MASH 시장 특성상 후속 개발 파이프라인들에 대한 관심도 높아질 것”이라고 진단했다.