지난 16일 덴마크 제약사는 룬드벡은 기업설명회를 통해 내년 CD40 리간드 타깃 자가면역질환 치료제 ‘APB-A1(LuAG22151)’ 임상 2상 진행 계획을 발표했다. APB-A1은 지난 2021년 에이프릴바이오(397030)가 룬드벡에 총 4억4800만 달러 규모로 기술이전한 물질이다. 룬드벡은 2022년 3월부터 미국에서 임상 1상 연구를 진행해왔다.
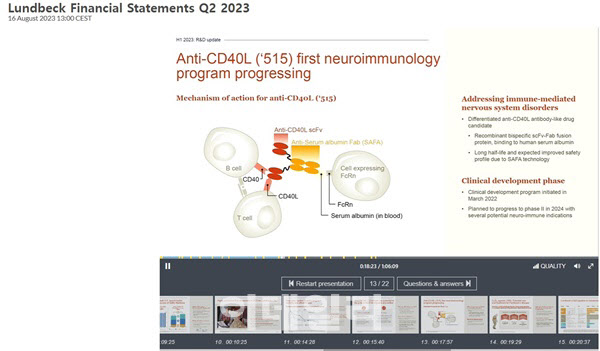
이날 발표에 나선 요한 루트만(Johan Luthman) 룬드벡 연구개발 수석 부사장은 “신약 후보물질 515(APB-A1)는 SAFA 플랫폼을 통해 CD40 리간드뿐만 아니라 인간 혈청 알부민과 결합해 긴 반감기를 가지며, 안전성 프로파일이 개선될 것으로 기대된다”며 “515 임상 1상은 용량 증가 연구에 대해 빠르게 진행되고 있다. 임상 2상은 2024년에 시작될 것으로 예상하며, 몇 가지 새로운 면역 질환 적응증을 탐색할 것”이라고 말했다. 이에 따라 에이프릴바이오는 내년 중 임상 2상 진입에 따른 마일스톤을 확보할 수 있게 됐다.
|
◇SAFA 플랫폼, 일각 우려도 싹 지웠다
요한 수석 부사장의 APB-A1 임상 2상에 대한 언급은 사실상 임상 1상에서 안전성을 확보한 것에 대한 자신감으로 풀이된다는 게 업계 분석이다. 룬드벡은 에이프릴바이오의 SAFA 플랫폼 원천기술에 매력을 느껴 후보물질을 도입했고, APB-A1을 자사 핵심 파이프라인으로 개발 중이다. 특히 룬드벡 측은 APB-A1의 질환 적응증 추가를 고려하고 있어 다양한 면역질환에서 가능성을 타진할 것으로 보인다.
에이프릴바이오가 독자 개발한 SAFA 플랫폼은 인간 Fab 항체 절편(SL335로 명명)을 활용, 약효 단백질의 혈청 내 반감기를 증대시키는 지속형 원천 기술이다. SAFA 플랫폼 기술을 활용해 개발된 것이 CD40L을 타깃하는 APB-A1 후보물질이다. 현재 상업화된 CD40L 타깃 치료제는 전무하고, 바이오젠의 다피로릴주맙이 전신홍반루푸스 환자 대상 임상 3상을 진행 중이다. 또 다른 치료제 루플리주맙은 임상 2상에서 혈전색전증 부작용이 발생했다. 이지수 다올투자증권 연구원은 “APB-A1은 경쟁 약물에서 발생했던 혈전색전증 부작용 없이 T세포 자극 저하 및 자가항체 생성을 억제해준다”며 “긴 반감기로 병원 방문 횟수 감소 등 투여 편의성도 있다”고 평가했다.
하지만 SAFA 플랫폼이 검증된 데이터가 없다는 점에 시장 일각에서는 우려를 제기한 바 있다. 따라서 곧 발표될 룬드벡의 임상 1상 데이터는 SAFA 플랫폼의 안전성을 입증하는 최초 검증된 데이터가 될 것이라는 게 업계 설명이다. 이동건 SK증권 연구원은 “이번 임상 1상이 에이프릴바이오에 갖는 의미는 SAFA 플랫폼이 적용된 파이프라인에서 첫 사람 대상 임상 결과라는 점”이라며 “SAFA 플랫폼에 대한 컨셉 입증에 중요한 임상이다. SAFA 플랫폼의 장점인 약효 단백질의 반감기 증가 및 부작용 위험 최소화 등에 대한 확인이 이뤄질 전망”이라고 분석했다. 에이프릴바이오 측은 “임상 1상이 잘 마무리된 것으로 보인다”면서도 “룬드벡과의 계약상 구체적인 입장 표명은 어렵다”고 말했다.
|
◇차상훈 대표 예언 현실화 되나...추가 기술수출 기대
“인간 항체는 이미 수많은 신약으로 쓰이고 있기 때문에 물질 자체의 타당성은 간접적으로 증명이 됐다. 룬드벡의 데이터로 안전성만 증명된다면 수많은 기술수출이 있을 것으로 자신한다.”
차상훈 에이프릴바이오 대표는 지난해 11월 이데일리와의 인터뷰에서 SAFA 플랫폼의 안전성이 확인 될 시 추가 기술수출에 대한 자신감을 피력한 바 있다. 따라서 업계에서는 룬드벡의 임상 1상을 통해 APB-A1의 안전성이 확인되면, SAFA 플랫폼의 안전성 역시 입증하는 것으로 추가 기술수출 가능성이 높아질 것으로 내다보고 있다.
회사는 6월 30일 기준 APB-A1 외 염증질환(APB-R3), APB-R4(자가면역질환), APB-BS2(삼중음성유방암), 고형암(APB-R5), 남성불임(APB-R2) 치료제를 개발 중이다. 이중 APB-R3는 호주에서 임상 1상을 진행 중이며, APB-R4는 글로벌 CRO를 진행 중이다. 또 APB-R5는 지난해 유한양행에 기술이전 돼 공동개발을 진행 중이다. 시장에서는 이 중 APB-R3의 기술이전 가능성을 언급하고 있다. APB-R3의 임상 1상 결과는 연내 발표될 것으로 전망된다.
이동건 SK증권 연구원은 “APB-R3는 희귀질환인 스틸병뿐만 아니라 시장 규모가 크고, 성장성이 높은 아토피, NASH 등 다양한 적응증의 가능성을 입증하고 있다. 에이프릴바이오는 임상 1상 결과를 바탕으로 글로벌제약사와의 기술이전을 추진 중”이라며 “EASL(유럽간학회)에서 APB-R3와 관련 2건의 연구결과를 발표했는데, GLP-1과 병용투여시 NASH 대상으로 단독투여 대비 높은 치료 효과를 확인했다. 일라이 릴리, 노보 노디스크 등 GLP-1 개발사들이 NASH 치료제 개발에 주력하고 있는 만큼 병용옵션으로서 APB-R3 가치가 더욱 부각될 전망”이라고 말했다.


!['범죄도시' 마동석의 43억 청담동 고급빌라 [누구집]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24051900140t.jpg)
![“아내 말레이 갔다”…피해자 시신 장소 숨기는 이기영 [그해 오늘]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24051800218t.jpg)
![‘아파트 공동명의' 조르는 아내, 이혼테크 수법일까요[양친소]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24051900076t.jpg)

