◇ 치매치료제 ‘도네페질’ 주도
|
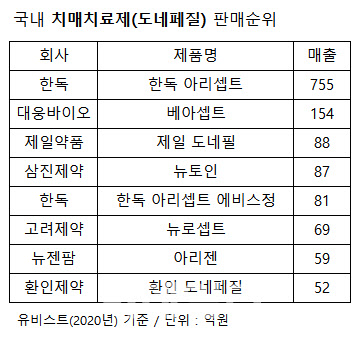
10일 제약업계에 따르면 지난해 국내 알츠하이머 치매치료제 시장 규모는 총 2900억원이다(시장조사기관 유비스트·원외처방액 기준). 이중 80%인 2300억원이 도네페질 성분 치매치료제에서 나온다. 판매액을 보면 한독(002390)이 판매하는 오리지널 약 ‘아리셉트’가 755억원으로 가장 많고 대웅바이오 ‘베아셉트’ 154억원, 제일약품(271980) ‘제일 도네필’ 88억원, 삼진제약(005500) ‘뉴토인’ 87억원 등의 순이다.
최근 미국 바이오젠과 일본 에자이가 공동 개발한 ‘아두카누맙(상품명 아두헬름)’이 미국 식품의약국(FDA)로부터 치매치료제로 승인을 받았다. 도네페질(아리셉트), 리바스티그민(엑셀론), 메만틴(나멘다), 갈란타민(라자딘)에 이어 18년 만에 나온 새로운 치매치료제다. 증세를 완화하는 효과만 있던 기존 치매치료제와 달리 아두카누맙은 질병 진행을 늦추는 효과가 나타난 것으로 알려졌다.
치매 환자가 매년 급증하는 상황에서 기존 치료제보다 진일보한 것으로 평가되는 치료제에 대한 수요는 클 수밖에 없다. 국립중앙의료원에 따르면 2019년 79만명이던 국내 치매환자는 2030년 136만명, 2040년 220만명, 2050년 300만명으로 늘어날 것으로 관측된다. 업계는 기존 국내 제약사들이 치매치료제로 올리던 매출 2900억원 가운데 상당 부분은 아두카누맙으로 이동할수 있다고 전망한다.
◇ “단기간 내 도입 어려워”
그럼에도 치매치료제를 판매하는 국내 업계는 아직은 여유있는 분위기다. 업계 관계자는 “환자들의 요구로 조건부 허가 방식으로 들여오는 가능성도 있지만 현재로서는 단기간 내 이뤄지기 어려울 것으로 본다”며 “아두카누맙이 복용 후 단기간 내 완치되는 치료제로 인정받은 것도 아니고 식약처의 허가 절차, 건보공단과의 협상 등 절차도 있기 때문”이라고 말했다.
아두카누맙은 아직 효능을 완전히 인정받지 못했다. FDA는 “임상에서 아직 효능에 불확실성이 남아있다”며 2030년까지 임상 4상에서 의도한 결과를 얻지 못할시 승인을 취소한다고 했다. 특히 조엘 퍼무터 워싱턴대 교수가 FDA 자문위원회를 관두기도 하는 등 결과에 반발도 컸다. 이같은 상황에서 식약처가 선뜻 허가를 내주기 어려울 것이란 관측이다. 식약처 의약품 승인은 일반적인 경우에도 120일 정도 걸린다.
식약처 허가 다음 단계인 건강보험 적용 심사 과정도 만만치 않을 것으로 예상된다. 아두헬름으로 판매되는 아두카누맙 가격은 환자당 연 5만6000달러(약 6200만원)다. ‘치매 국가책임제’에서 알 수 있듯 정부가 치매 지원을 중시하지만 고가인 점은 부담이다. 지난달 말 식약처 허가를 받은 천수성 근육위축증 치료제 ‘졸겐스마’도 1회 투여비가 25억원(미국 기준)인 탓에 허가까지 난항이 있었던 것으로 전해진다. 또 허가 후 건강보험 적용까지도 최소 180일은 소요된다.
업계 관계자는 “고가라는 점은 국내 시장 도입에 큰 진입장벽이 될 것”이라며 “아두카누맙 특허가 끝난 후 복제약이 많이 나오고 가격이 인하돼 많은 사람들이 사용하기 전까지는 국내 도네페질 시장이 갑자기 작아지지는 않을 것”이라고 내다봤다.


![환경미화원 향해 '까딱까딱' 내민 봉지...반전 결말 [영상]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/09/PS24092700952t.jpg)


