|
신영기 에이비온(203400) 대표(서울대 약학대학 교수)는 클라우딘3 항체 치료제 개발의 어려움에 대해 이같이 설명했다. 신 대표는 “클라우딘 단백질 중에서 3, 4, 5, 6, 8, 9, 17 등은 서열유사도가 높아 선별이 쉽지 않다”면서 “세계적으로 클라우딘3 항체를 개발하기 위해 다양한 시도가 있었지만 현재까지 개발된 치료제가 없는 이유”라고 설명을 곁들였다.
실제로 클라우딘6 표적 항체인 일본 아스텔라스의 IMAB027은 클라우딘9 등과 결합 사례가 보고되기도 했다. 여타 클라우딘 항체 치료제가 다른 단백질을 표적으로 인식해 결합한단 얘기다. 에이비온은 현재 클라우딘3 항체치료제 ‘ABN501’ 전임상을 진행 중이다.
에이비온은 지난달 ABN501에 대해 미국 국립보건원(NIH) 산하 국립암센터(NCI)와 비임상 공동연구를 개시했다. 에이비온이 세계에서 유일하게 클라우딘3 단백질 항체를 보유한 곳라는 점이 작용했다.
이데일리는 2일(현지시각) 시카코에서 열리고 있는 미국임상종양학회(ASCO 2024)에서 신 대표를 비롯 에이비온 관계자를 만나 클라우딘3 항체치료제 ABN501 경쟁력과 향후 전망에 대해 살펴봤다.
◇ 클라우딘3 암 치료 판도 바꿀 것
클라우딘3 항체 치료제 개발에 성공한다면 암 치료에 판도 자체가 바뀔 수 있다는 평가다. 우선, 항암 치료 부작용을 크게 줄일 수 있다.
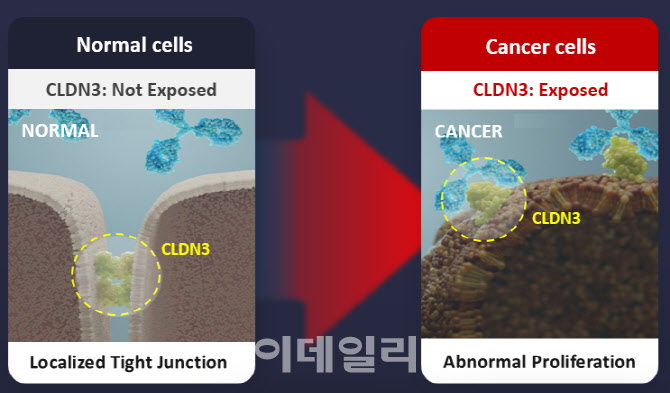
이세형 에이비온 연구소장은 “클라우딘3 단백질은 여러 고형암에서 과발현된다”면서 “이를 표적하는 항체 치료제가 개발되면, 정상 세포는 건드리지 않고 암세포만 살상하면서 치료 효능을 극대화할 수 있다. 당연히 정상세포를 건드리지 않기 때문에 부작용이 최소화된다”고 설명했다.
클라우딘3가 정상세포·암세포 모두에 존재하는데 어떻게 암세포만 골라 표적할 수 있는지를 묻자, 이 연구소장은 “정상세포에선 클라우딘3 단백질이 발현되더라도 세포와 세포 사이에 숨어 밖으로 노출되지 않는다”면서 “당연히 항체와 결합하지 않는다”고 답했다.
신영기 에이비온 대표(서울대 약학대학 교수)는 “정상조직에선 촘촘한 세포 접합부에 위치하지만 종양(암세포) 형성 과정에서만 밖으로 노출된다”고 설명을 곁들였다.
|
정상세포에서 클라우딘3는 세포와 세포사이 밀착·접합 등의 접착제 역할을 하며 물질 이동을 차단하는 역할을 한다. 암세포는 비정상적으로 빠르게 늘어나기 때문에 세포 간 구조를 만들지 못해 접착부위가 노출된다. 이 같은 이유로 클라우딘3는 암세포에서만 노출돼 항체가 결합할 수 있다.
◇ 클라우딘3 항체 치료제 개발 난제였지만 극복
하지만 클라우딘3 항체치료제를 개발하는 일은 난제 중의 난제다. 앞서 언급한 서열 유사성 외에도 항원을 재현하는 일이 불가능에 가까웠기 때문이다.
항원단백질을 재현하는 것은 치료제 개발에 있어 매우 중요하다. 항체는 항원과 결합하기 때문에, 항원 단백질을 재현해야, 항체가 정확히 어디에 결합하는지, 결합력이 얼마나 되는지 등을 확인할 수 있다.
이 연구소장은 “초기에는 전통적인 항원 단백질 재현법인 ‘펩타이드’나 ‘재조합 단백질’로 시도했었다”면서 “히지만 이 방법으로는 실제 인체 내 클라우딘3 단백질과 완벽하게 동일한 형태를 만들기 어렵다는 결론을 내렸다”고 말했다.
그는 이어 “대신 세포 기반 리포솜 입자를 이용해 클라우딘3 단백질을 똑같이 재현하는 방식으로 항원을 만들어냈다”며 “이 항원을 통해 클라우딘3에만 결합하는 항체를 선별할 수 있었다”고 밝혔다.
리포솜은 세포막과 유사한 구조를 가지고 있다. 주로 약물 전달 시스템에 사용된다. 클라우딘3 단백질이 세포막 역할을 하며 세포 간 접착제 역할을 한다는 것에 착안한 것이다.
◇ 1상에서 안전성 검증하면 기술수출 가능성 높아
클라우딘 단백질이 24종이나 되는 데, 클라우딘3 항체 치료제 개발이 갖는 의미를 묻자, 이 연구소장은 “다른 클라우딘 단백질은 특정 암에서만 과발현된다”면서 “하지만 클라우딘3 단백질은 여러 종류의 고형암에서 발현된다”고 설명했다.
여타 클라우딘 항체 치료제는 일반 열쇠라면, 클라우딘3 항체 치료제는 여러 문을 열 수 있는(모든 암을 치료할 수 있는) 만능열쇠인 셈이다.
구체적으로 클라우딘6는 난소암, 고환암 환자, 클라우딘18.2는 위암, 식도암, 췌장암으로 한정돼 있다. 세계 최초로 승인받은 클라우딘 18.2 항체 치료제 역시 위장암으로 적응증이 제한된다.
에이비온은 ABN501이 빠른시일 내 기술수출이 가능할 것으로 내다봤다. 그는 “클라우딘 항체 치료제는 정상세포를 건드리지 않기 때문에 안전하다”면서 “품목허가받은 클라우딘 18.2 항체치료제도 상당히 안전했다”고 진단했다. 이어 “ABN501이 임상 1상에서 안전성을 검증한다면 글로벌 제약사 관심이 높아질 것”이라고 덧붙였다.
신 대표는 실제 개발 초기단계인 상태에서도 다국적 제약사의 문의가 이어지고 있다고 귀띔했다.
에이비온은 ABN501 개발 속도를 높일 계획이다. 신 대표는 “ABN501은 내년 하반기까지 한국과 미국을 포함한 국가에 임상시험계획(IND)을 제출하는 것을 목표로 전임상 독성 연구가 진행 중”이라고 밝혔다..


![시신에 '전분' 뿌린 남자…울면서 재연한 그날의 범행[그해 오늘]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/06/PS24062100001t.jpg)


