|
3일 식약처의 국내 의약품 허가보고서에 따르면, 지난해 신약은 35개 품목이 허가됐다. 이 가운데 국내 제약 바이오 회사들이 자체 개발한 국산 신약은 없다. 나머지는 수입하거나 국내회사가 해외 신약 판권을 사들여 국내에서 제조해 허가를 받는 경우다.
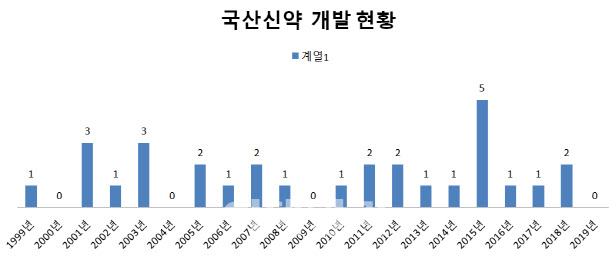
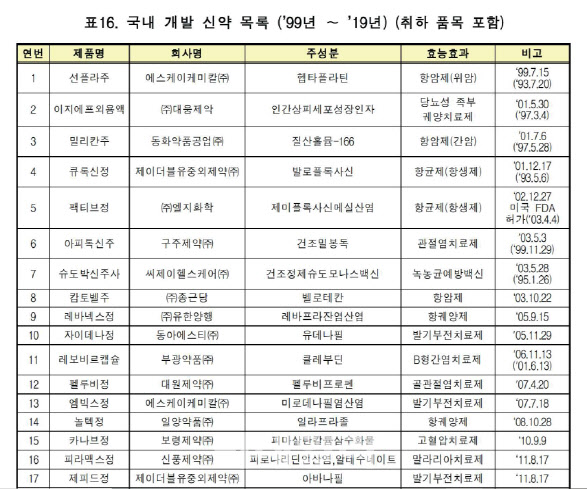
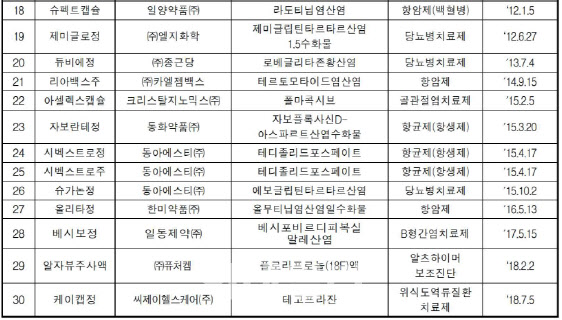
국산신약은 1999년 SK케미칼의 위암 치료제 선플라주가 1호로 등장한 이후 대체로 매년 1개 이상이 나왔다. 2015년의 경우 크리스탈니노믹스의 골관절염 치료제 ‘아셀렉스캡슐’, 동화약품(000020)의 항균제 ‘자보란테정’, 동아에스티(170900)의 항균제 ‘시벡스트로정·주’, 동아에스티의 당뇨병치료제 ‘슈가논정’ 등 5개가 허가를 받았다.
하지만 2018년 씨제이헬스케어의 위식도 역류질환 치료제 ‘케이캡정’ 이후에는 추가로 허가받은 제품이 없다. 이는 바이오기업을 중심으로 개발 단계부터 글로벌 시장(미국)을 목표로 해외에서 신약허가를 먼저 받고 국내는 나중에 허가받는 전략을 취하고 있기 때문으로 풀이된다.
실제 신라젠, 헬릭스미스, HLB, 메즈온 등이 국내를 건너뛰고 미국, 유럽 등을 중심으로 신약개발에 도전하고 있다. 국산 첫 독자개발로 미 FDA 승인을 받은 SK바이오팜의 뇌전증 치료 신약 ‘세노바메이트’도 미국 현지화 채널을 통한 직접 개발로 FDA를 먼저 통과했다.
이른바 ‘식약처 패싱’ 현상이다. 이를 두고 일각에서는 국내 식약처의 심사능력과 심시기간 등에 대한 볼멘소리를 내놓는다. 하지만 이는 식약처의 무능이라기보다 결국 미국 시장이 세계 최다 의약품 시장인 데다 글로벌 시장을 공략해 제대로 된 성과를 내려면 FDA를 뚫지 않고서는 방법이 없기 때문이라는 목소리도 만만치 않다.
|
국산신약이 더 나오지 않는 것은 거꾸로 국산신약 개발 성공의 타이틀 보유가 별 의미가 없다는 인식이 퍼진 것과도 무관치 않다는 분석이다. 가령 1999년 SK케미칼의 위암 치료제 선플라주가 나올 때만 해도 ‘국산 신약00호’라는 간판이 주는 상징성이 적지 않았다.
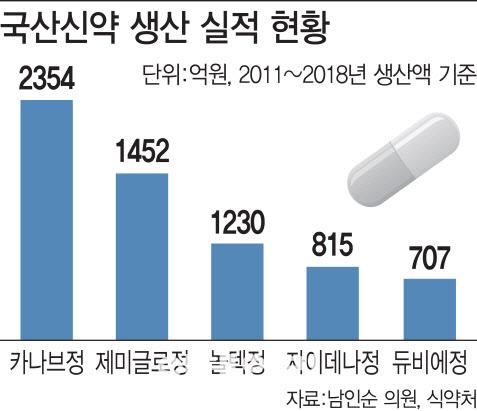
이 때문에 실제 약의 효과나 판매 성과에 초점을 두기보다는 ‘간판용’으로 신약을 개발한 뒤 실제 판매에 나서지 않는 약이 나오기도 했다. 사실 국산 신약이 시장에서 성과를 내기 시작한 것은 2010년 보령제약(003850)의 고혈압 치료제 ‘카나브정’이 등장한 이후 LG화학(051910)의 당뇨병 치료제 ‘제미글로정’, 일양약품(007570)의 항궤양 치료제 ‘놀텍정’ 등의 제품에 이르러서라는 게 대체적 시각이다.
이와 함께 동물실험 단계나 임상 1상 등 초기 단계에 후보물질을 글로벌 제약회사에 이전하는 기술수출이 또다른 뚜렷한 신약개발 흐름을 형성하고 있는 것도 식약처 패싱 현상을 부르는 이유로 꼽힌다.
|
|




![벽에 던져져 숨진 세살 아기…30대 남성은 왜 그랬을까[그해 오늘]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/06/PS24062700001t.jpg)
