|
◇루게릭병 환자 세계 35만 명, 치료 입증된 약물 無
루게릭병은 신경세포가 손실돼 운동 능력을 잃게 되는 퇴행성 질환이다. 루게릭병 환자 중 95%는 명확한 발병원인을 파악할 수 조차 없다. 나머지 5%만이 가족력에 의한 유전적 원인이 작용하는 것으로 알려졌다. 루게릭병의 발병부터 사망까지 평균 생존기간은 2~4년이지만, 호킹처럼 약 10%의 환자는 10년 이상 생존한다.
시장조사기업 그랜드뷰리서치에 따르면 세계 루게릭병 환자는 35만 명 이상이며, 미국 내 환자는 전체의 약 10% 내외다. 국내에는 약 3000명의 환자가 있는 것으로 알려졌다. 루게릭병 치료제 시장 규모는 2026년경 8억8000만 달러(한화 약 1조661억원)에 이를 전망이다.
국내외 기업이 현재까지 확인된 루게릭병의 발병 원리에 맞춘 약물이 다각도로 개발하고 있지만, 아직 치료 효과가 입증된 것은 없다. 미국 식품의약국(FDA)의 승인을 받은 프랑스 사노피의 ‘리루텍’(성분명 리루졸)과 일본 미쓰비시다나베제약(다나베제약)의 ‘라디컷’(성분명 에다라본) 등도 루게릭병의 증상을 완화하는 효과만 확인된 상태다.
특히 리루졸은 1995년 미국 식품의약국(FDA)으로부터 최초로 승인받은 루게릭병 관련 경구형 화합물이다. 이 물질은 루게릭병 환자에 뇌에서 다량으로 발견되는 글루타메이트의 작용을 억제해 병증을 완화한다. 반면 앰플형인 라디컷은 항산화제 역할을 하는 화합물로, 그 작용과정이 명확하지 않음에도 소규모 임상에서 루게릭병 증세 지연 효과가 나타나 2017년 FDA의 승인을 받았다.
지난 3월 식품의약품안전처가 다나베제약이 경구형으로 재개발한 라디컷에 대해 추가 임상 3상을 승인했다. 업계에서는 미국과 일본 등 의약 당국에 회사 측이 경구형 라디컷의 허가 신청을 완료하면서 시장을 선점하고 있는 리루텍을 추격할 발판을 마련하고 있는 것으로 분석하고 있다.
◇화합물 vs.줄기세포...접근 방식별 희비 갈려
문제는 현재 사용 중인 리루졸이나 라디컷이 뇌 속에서 어떤 부수적인 작용을 하는지 명확히 알지 못한다는 것이다. 루게릭병에 타격을 줄 명확한 기전을 파악해 이를 타깃하는 신약 개발이 필요하지만 난항이 계속되는 상황이다.
지난달 30일 FDA는 미국 아미릭스 파마슈티컬스가 개발 중인 루게릭병 치료제 ‘AMX0035’(성분명 페닐부티르산나트륨 및 타우루르소디올)의 허가 신청 건에 대해 반대 권고를 내렸다. FDA는 임상 시험 완료한 환자 수가 예정된 인원의 50%에 불과해 데이터가 불충분해 효능 입증이 제대로 안 됐다는 이유를 제시했다.
AMX0035는 2가지 활성 화합물을 넣은 경구형 복합 약물이다. 이 물질은 운동 신경세포 내 소포체 스트레스 및 미토콘드리아 기능 장애를 완화하는 등 신경퇴행성 질환의 다중 파괴 경로에 작용하는 것으로 알려졌다.
국내 루게릭병 치료제 개발 업계 관계자는 “생체 내 신경질환은 그 기전이 특히 복잡하고 설계한 약물이 제대로 작용하는지 명확한 데이터로 입증하기도 까다롭다”며 “최근까지 코로나19로 임상연구를 제대로 수행하기도 쉽지 않았던 것도 개발을 더디게 했다”고 말했다.
한편 FDA는 지난해 12월 미국 줄기세포전문기업 브레인스톰 셀 테라퓨틱스(브레인스톰 셀)의 ‘뉴로운’(성분명 MSC-NTF 세포)에 대해서는 조기투약프로그램(EAP) 확장을 승인한 바 있다. 이 약물은 환자의 골수에서 채취한 중간엽줄기세포(MSC)로 만든 재생치료제다.
브레인스톰 셀은 환자의 근육 또는 척추관을 통해 뉴로운을 주입하면, 이 세포가 신경영양인자를 분비해 운동 신경세포를 재생시키는 효과가 있을 것으로 기대했다. 하지만 뉴로운의 성공 여부 역시 미지수다. 회사 측이 지난 2020년 임상 3상 결과 위약대비 통계적 유의상을 확보하지 못한 채 품목 허가를 추진하고 있기 때문이다.
|
◇코아스템·아미코젠파마 등 루게릭병 치료제 임상 3상 진행
국내 기업들도 루게릭병 치료제 개발에 열을 올리고 있다.
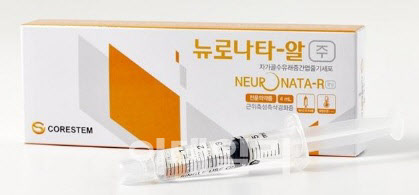
먼저 코아스템(166480)은 자사 루게릭병 대상 줄기세포 재생치료제 ‘뉴로나타-알’의 글로벌 임상 3상(미국 등)을 진행하고 있다. 뉴로나타-알은 2014년 식품의약품안전처(식약처)로부터 임상 3상을 조건으로 품목 허가를 받고 이듬해 국내에서 출시한 바 있다.
코아스템 관계자는 “루게릭병은 사망까지 이르는 병이다. 최대한 효과를 내기 위한 일환으로 증상 완화제와 병용임상이 선호되고 있다”며 “신경재생효과가 예상되는 우리 약물과 병증의 지연 효과가 있는 리루졸 등을 병용하는 임상을 설계해 1,2상을 진행했고 3상에서 대상을 확대해 적합성을 분석할 예정이다”고 설명했다.
또 아미코젠(092040) 관계사 아미코젠파마도 자사의 ‘AGP600’에 대해 올 상반기 임상 3상 첫 투약 개시 예정이다. 아미코젠은 2020년 유스바이오팜의 지분 54.76%를 50억원에 인수했고, 이듬해 아미코젠파마로 사명을 변경했다.
유스바이오팜은 2009년 국내 최초로 항산화기능 등을 가진 루게릭병 진행 억제제 ‘유스뉴로솔루션’(성분명 우르소데옥시콜산)을 개발해 임상 3상을 진행하는 조건으로 식약처로부터 품목허가를 획득했다. 하지만 자금난으로 회사 측이 제때 추가 임상 3상 진행하지 못했고, 2018년 유스뉴로솔루션의 허가는 취소됐다. 이후 아미코젠파마가 이 물질의 명칭을 AGP600으로 수정해 지난해 임상 3상을 재개를 승인 받았다. 회사 관계자는 “현재 자세한 진행 내용을 언급할 단계가 아니다”고 일축했다.
이 밖에도 바이오벤처 지뉴브가 루게릭병 치료제 ‘SNR1611’(성분명 트라메티닙)에 대한 임상 1/2a상을 진행 중이다. 트라메티닙은 스위스 노바티스가 개발해 FDA에서 승인받은 항암제의 성분이지만, 회사 측이 새로운 적응증으로 발굴했다. 지뉴브 측은 쥐 실험에서 트라메티닙이 비정상적 단백질의 응집을 막아 척수 운동 신경세포를 보호하는 효과를 나타내는 것을 확인했으며, 연내 이번 임상의 결과를 도출할 수 있을 것으로 전망하고 있다.


![228명 태운 비행기, 하늘에서 사라졌다…승객 ‘전원 사망' [그해 오늘]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/06/PS24060200002t.jpg)
![코인 손댔다가…김동현, 반포자이 '반전세' 사연은 [누구집]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/06/PS24060200038t.jpg)
![겁나 험한게 나왔다…롯데리아의 파묘 '오징어버거'[먹어보고서]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/06/PS24060200064t.jpg)
![핸드폰으로 ‘女 다리 사진' 몰래 찍는 남편, 어떡하죠[양친소]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/06/PS24060200024t.jpg)