|
파로스아이바이오가 개발중인 PH-101이 식품의약품안전처에서 치료목적 사용승인을 받았다.
치료목적 사용승인은 생명이 위급하거나 중대한 상황에 처한 상황에서 사용할 수 있는 치료옵션이 없는 환자에 한해 연구개발 중인 약물을 사용할 수 있도록 허가하는 제도다.
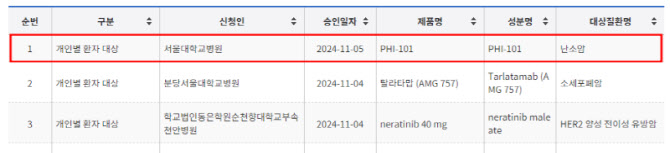
7일 식품의약품안전처 의약품안전나라에 따르면 파로스아이바이오의 PHI-101은 지난 5일 서울대병원에서 난소암 환자에게 사용하는 것을 목적으로 치료목적 사용승인을 받았다.
PH-101은 파로스아이바이오의 인공지능(AI) 신약 개발 플랫폼 ‘케미버스’를 이용해 심장독성 예측을 거쳐 발굴한 약물이다.
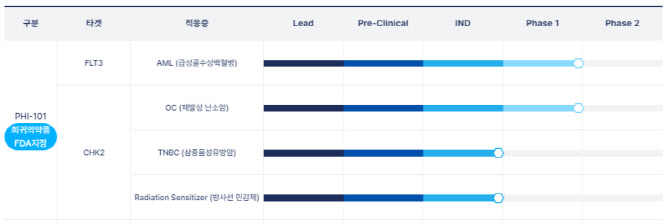
파로스아이바이오는 현재 PH-101을 급성골수성백혈병(AML)과 난소암 치료제로 개발하고 있다. AML의 경우, PH-101이 FLT3를 저해하고 난소암에서는 CHK2를 억제하는 기전으로 항암효과가 나타날 것으로 기대하고 있다.
파로스아이바이오는 현재 난소암을 적응증으로 PHI-101의 안전성, 내약성을 분석하기 위한 국내 임상1상을 진행하고 있다. AML에 대해서는 글로벌 임상1상을 진행하고 있다.
|
<파이낸스스코프 서윤석 기자 yoonseok.suh@finance-scope.com>
본 기사는 투자 참고용으로 이를 근거로 한 투자 손실에 대해 책임을 지지 않습니다.
해당 기사는 파이낸스스코프(http://www.finance-scope.com)가 제공한 것으로 저작권은 파이낸스스코프에 있습니다.
본 기사는 이데일리와 무관하며 이데일리의 논조 및 편집 방향과 다를 수 있습니다.
기사 내용 관련 문의는 파이낸스스코프로 하시기 바랍니다.