|
26일 제약바이오업계에 따르면, 동아ST는 지난 24일 얀센의 자가면역질환 치료제 ‘스텔라라’의 바이오시밀러 ‘DMB-3115’에 대한 임상 3상 시험 계획을 미국 식품의약국(FDA)에서 승인 받았다. 동아ST 관계자는 “1분기 내 미국 임상 3상을 개시하고 순차적으로 유럽 9개국에서 임상 3상 시험계획을 신청할 예정”이라고 말했다.
스텔라라는 얀센이 개발한 건선, 크론병, 궤양성 대장염 등 자가면역질환 치료제다. 2019년 기준으로 전세계 매출 7조원을 기록한 블록버스터다. 미국과 유럽에서 물질특허가 각각 2023년 9월과 2024년 7월에 만료되는 만큼 개발 경쟁이 뜨겁다. 실제 바이오시밀러 강자 셀트리온 역시 지난해 12월 이 약의 바이오시밀러 글로벌 임상 3상을 개시했다. 셀트리온은 2022년 하반기 임상 3상 종료를 목표로 하고 있다.
전통 제약사와 국내 바이오시밀러 강자와의 대결은 안과질환 치료제 시장에서도 이어진다. 삼성바이오에피스는 ‘시력도둑’ 황반변성 치료제 루센티스의 바이오시밀러(SB11) 허가 신청을 하고 승인을 기다리고 있다. 삼성바이오에피스 관계자는 “유럽(EMA)과 미국(FDA)이 각각 지난해 10월과 11월에 허가 심사에 착수했다”고 말했다. 통상 해당 심사에는 1년~ 1년반 정도가 걸려 이르면 연말께 허가를 기대해볼 수도 있는 상황이다.
루센티스는 제넨텍이 개발해 로슈와 노바티스가 판매하는 황반변성 치료제로 2019년 한해 매출이 4조6000억원에 달한다. 물질특허는 유럽의 경우 2022년 1월 만료되고 미국은 지난해 6월에 이미 끝났다. 종근당(185750)도 루센티스 바이오시밀러(CKD-701)의 국내 임상 3상을 진행하며 추격전을 벌이고 있다. 종근당 관계자는 “올해 3상을 마무리하는 게 목표”라며 “글로벌 임상 진행도 검토 중”이라고 말했다.
또다른 안과질환 치료제 아일리아 바이오시밀러 시장 경쟁은 더 치열하다. 삼성바이오에피스, 알테오젠(196170), 삼천당제약(000250) 등이 개발에 뛰어들었다. 알테오젠은 이달 바이오시밀러 개발을 위해 설립한 자회사 알토스바이오가 벤처펀드 등으로부터 605억원의 투자유치를 완료했다. 아일리아 바이오시밀러 해외 임상 등을 위한 실탄을 확보한 셈이다. 알테오젠 관계자는 “ 국내 임상 1상은 마무리됐다”며 “글로벌 3상도 조만간 시작할 예정”이라고 말했다.
아일리아는 리제네론과 바이엘사가 개발한 황변변성 치료제로 2019년 기준 매출이 8조7000억원에 이른다. 물질특허가 미국은 2023년 6월, 유럽은 2025년 5월에 만료된다. 삼성바이오에피스 역시 지난해 7월 아일리아 바이오시밀러(SB15) 글로벌 임상 3상에 본격 착수해 2022년 2월 임상 완료를 목표로 하고 있다. 삼천당제약 역시 아일리아 바이오시밀러 글로벌 3상에 들어갔다. 삼천당 관계자는 “내년 상반기 완료를 목표로 하고 있다”며 “투약 주기를 늘려 복용 횟수를 줄이는 바이오베터 제품도 검토 중”이라고 말했다.
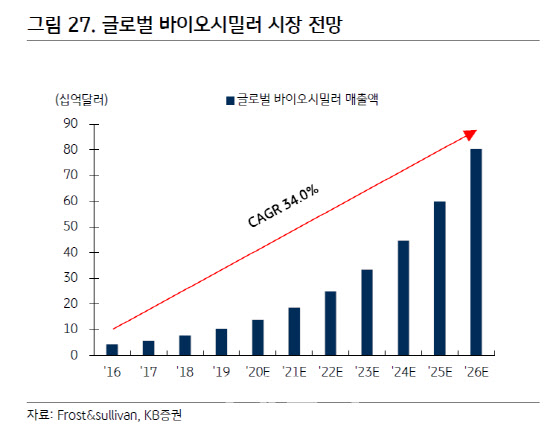
바이오시밀러 시장은 복제약 특성상 어느 시장보다 선도자 이점이 큰 시장이다. 셀트리온의 자가면역질환 치료제 바이오시밀러 램시마와 혈액암 치료제 바이오시밀러 트룩시마가 각각 세계와 미국에서 가장 먼저 출시돼 시장 선점 효과를 톡톡히 누린 게 대표적 예다. 업계 관계자는 “고령화와 각국 의료보험 재정 문제로 바이오시밀러 시장의 고성장은 당분간 계속될 것”이라며 “선도자가 되기 위한 경쟁이 더 치열해질 것”이라고 말했다. 글로벌 시장조사기관(Frost&sullivan)에 따르면 글로벌 바이오시밀러 시장은 2016년 42억달러(4조7000억원)에서 2026년 800억 달러(89조원)로 연평균 성장률(CAGR) 34% 성장이 전망된다.

![국민 10명 중 7명 尹 탄핵 찬성…부산·대구에서도 60% 이상[리얼미터]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24120500353t.jpg)


