미국이나 유럽 연합(EU) 등 주요국에서 관련 물질의 허가 절차를 밟고 있는 셀트리온(068270)과 동아에스티(170900) 등이 이를 예의주시하고 있다. 삼성바이오에피스도 지난달 스텔라라 바이오시밀러 후보 ‘SB17’의 임상 3상 결과를 처음으로 발표하면서 잰걸음을 내고 있다.
|
미국 얀센이 개발한 스텔라라는 인터류킨(IL)-12와 IL-23을 동시에 억제하는 기전을 가졌다. 2008~2009년 사이 캐나다와 EU, 미국 등에서 중증도~중증의 판산 건선 치료제로 처음 승인된 약물이다. 최근까지 회사는 스텔라라의 적응증을 건선 관절염, 크론병, 궤양성 대장염 등 4종으로 확대하는 데 성공했다.
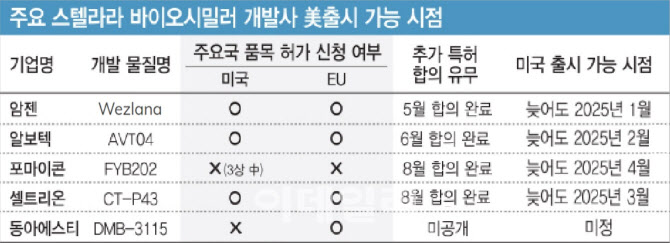
지난해 기준 스텔라라의 글로벌 매출은 97억 달러(당시 한화 약 12조원)를 기록한 것으로 집계됐다. 이중 약 65%(63억8800만 달러)가 미국 시장에서 발생했다. 이 때문에 임상 3상 이상 단계에 스텔라라 바이오시밀러를 확보한 7곳의 국내외 개발사들이 미국 시장 진출에 전력을 다하고 있다.
그런데 지난달 31일(현지시간) FDA가 암젠이 개발한 위즈라나를 퍼스트 인터체인저블 바이오시밀러로 승인했다고 밝혔다. 위즈라나는 미국 내 스텔라라의 퍼스트 바이오시밀러이면서, 상호교환성 지위까지 단숨에 획득한 약물이 됐다.
바이오시밀러 개발 업계 관계자는 “암젠이 위즈라나를 출시할 경우 1년간 상호교환성 지위를 이용한 약국 내 대체처방권을 독점할 수 있다”며 “경쟁사보다 비교우위를 점할 수 있게 된 것”이라고 설명했다.
물론 암젠이 승인받은 위즈라나를 곧바로 출시할 수 있는 것은 아니다. 스텔라라의 물질특허는 미국에서 올해 9월 만료됐지만, 신규 적응증에 대한 용도 특허 등이 남아 있는 상황이었다. 얀센이 2종의 용도 특허를 암젠이 침해했다고 소송을 제기해 양사가 소송을 진행했지만, 지난 5월 합의를 도출했다.
앞선 관계자는 “암젠이 로열티를 더 준다는 내용과 같은 추가 논의를 진행해 위즈라나 출시가 앞당겨질 가능성을 배제할 순 없지만, 현재로서는 2025년에 출시된다고 봐야 한다”며 “알보텍, 포마이콘, 셀트리온 등도 2025년 상반기 중 스텔라라의 남은 특허에 대해 얀센과 합의를 본 상태다. 이들의 미국 시장 경쟁은 2025년에 본격화될 것”이라고 말했다.
|
“셀트리온이 가장 빨라”...동아ST·삼성에피스 등 5곳도 잰걸음
암젠에 뒤를 이어 미국에서 스텔라라 바이오시밀러의 승인 절차를 빠르게 진행한 곳은 아이슬란드 알보텍과 셀트리온 등이 꼽힌다.
알보텍은 지난 달 FDA로부터 자체 스텔라라 바이오시밀러 ‘AVT04’의 제조시설 문제로 허가 반려 통보를 받았다. 회사는 이를 보완해 재신정 절차를 밟을 계획이다. AVT04가 지난 9월 일본에선 승인된 바 있어, 물질 자체에는 문제가 없다는 설명이다.
미국과 유럽에서 이미 허가 심사가 개시된 셀트리온의 스텔라라 바이오시밀러 ‘CT-P43’도 있다. 지난 8월 셀트리온은 암젠과의 특허합의를 통해 늦어도 2025년 3월 7일부터 CT-P43을 미국에서 출시할 수 있는 권리도 획득한 바 있다. CT-P43은 허가 단계상 국내외 개발사의 물질을 통틀어 두 번째 스텔라라 바이오시밀러로 미국에서 허가될 유력한 후보로 평가되고 있다. 회사는 내년 중 CT-P43이 미국에서 승인될 것으로 전망하고 있다.
국내사 중 동아에스티와 삼성바이오에피스 등도 관련 물질의 미국 시장 진출을 계획하고 있다. 동아에스티는 연내 스텔라라 시밀러 ‘DMB-3115’에 대한 허가신청서를 FDA에 제출할 예정이다. 해당 물질은 지난 7월부터 유럽의약품청(EMA)의 허가 심사를 받는 중이다. 미국과 유럽내 DMB-3115의 허가 절차는 인도 인타스 파마슈티컬스(인타스)가 주도하고 있다.
동아에스티 관계자는 “DMB-3115의 미국 내 허가 신청서 제출 시점이 당초 올해 2~3분기에 완료할 예정이었지만, 조금 밀려서 올해 중으로 진행할 것으로 파악하고 있다”며 “스텔라라 남은 특허에 대한 경쟁사들의 합의 관련 내용은 확인하고 있다. 다만 인타스 측이 주도하기 때문에 아직 우리 물질에 대한 관련 내용은 공개할 부분이 없다”고 설명했다.
지난달 12일 삼성바이오에피스가 스텔라라 바이오시밀러 ‘SB17’의 암상 3상 결과 오리지널과 동등성을 확보했다는 분석 결과를 내놓았다. 지난해 12월 해당 임상을 완료한 지 약 1년만이다. 이밖에도 독일 포마이콘(FYB202, 임상 3상 완료)과 중국 바이오테라솔루션즈(BAT2206, 임상 3상 진행 중) 등도 스텔라라 바이오시밀러를 개발하고 있다.
스텔라라 시밀러 개발업계 또다른 관계자는 “스텔라라의 적응증 별로 성인에서 소아로 투약 연령 확대 임상을 진행하기 보다 상호교환성을 인정받는 것이 더 빠르게 시장성을 확대하는 방법일 수 있다”며 “스텔라라 시밀러 개발사들이 암젠의 위즈라나가 보유하게된 독점권이 끝나기 전에 상호교환성 지위를 획득을 하려는 움직임을 보일 것”이라고 전망했다.





![SK, 역대 최대 5조1575억원 자사주 소각 결정…애프터마켓 10%대 급등[특징주]](https://image.edaily.co.kr/images/Photo/files/NP/S/2026/03/PS26031001416t.jpg)



