|
우선, FECS-Ad의 투여에 따른 안전성 평가 결과 임상시험 전 기간에 걸쳐 중대한 이상사례(SAE) 및 중대한 약물이상반응(SADR)이 단 한 건도 발생하지 않아 탁월한 안전성이 입증됐다.
유효성 평가 결과 중증하지허혈의 치료 및 증상개선에 있어 가장 우선시되는 항목인 허혈성 통증 지표의 경우 FECS-Ad를 투여받은 저용량군 및 고용량군 환자 전체에서 베이스라인 대비 각 관찰시점에서 통계적으로 유의미하게 통증이 감소함을 확인했다. 각 용량군에 있어 허혈성 통증 지표(VAS)의 변화는 투여 전 베이스라인 대비 투여 24주 후에 저용량군에서 73% 통증 감소(투여 전 통증 수치 평균 49.1에서 투여 후 24주 시점에 평균 7.7로 감소), 고용량군에서 96% 통증 감소(투여 전 통증 수치 평균 52.9에서 투여 후 24주 시점에 평균 1.5로 감소)를 보였다.
중요한 점은 이러한 허혈성 통증 지표의 감소 효과로 인해 실제 환자에서 FECS-Ad 투여 후 4주차부터 임상 완료 시점인 24주까지 휴지기 통증(rest pain)이 없는 수준으로 유지됐다.
또 다른 유효성 평가지표인 무통증 보행거리는 각 시험군에서 베이스라인 대비 FECS-Ad 투여 후 4주, 12주, 24주에 모두 증가하는 경향을 보였다. 또한, 궤양이 진행된 환자의 경우 베이스라인 대비 각 관찰시점에 궤양의 면적이 점차 감소했으며, 24주 시점에는 베이스라인 대비 62%까지 감소(투여 전 궤양 면적 130mm2에서 투여 후 24주 시점에 49mm2로 감소)했다.
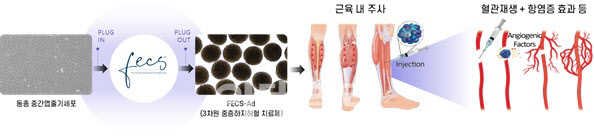
본 임상시험의 유효성 평가 지표 중 줄기세포 치료제의 메커니즘과 관련된 허혈성 통증 감소, 무통증 보행거리 증가 및 궤양 면적 감소는 예상 했던 바와 같이 효과를 보인 반면, 줄기세포 치료제의 메커니즘과 관련이 없을 것으로 예상한 발가락(TBI) 및 발목 상완지수(ABI)는 유의한 변화가 없었다. 그러나, 미세혈관 신생 유도 및 항염증 메커니즘을 통해 중증하지허혈의 근본적인 증상인 통증 및 궤양 등이 개선된 것을 확인함으로써 유효성이 입증되었다고 할 수 있다.
이에 회사는 FECS-Ad의 차단계 임상시험에서 줄기세포 치료제의 주요 메커니즘인 미세혈관 신생 및 항염증 기능과 관련된 통증 감소, 무통증 보행거리 증가, 궤양 감소 등의 지표를 주평가 지표로 설정할 계획이며, 이를 검증하기 위하여 혈관조영술 및 적외선체열검사 등과 같은 영상검사 방법도 도입할 예정이다.
임상시험을 주도한 삼성서울병원 혈관외과 김동익 교수는 결과보고서를 통해 FECS-Ad의 안전성에 대해 “시험군 전례에서 중증 이상 반응 발생 사례가 없었으며, 실험실적 검사, 신체검진, 심전도 검사 결과 등을 분석하여 본 바, 본 치료제는 향후 동맥폐색으로 인한 하지허혈증 환자에게 치료제로 사용하기에 안전성이 인정되리라 기대한다”고 했다.
총괄기술책임자인 에스바이오메딕스 김동욱 대표(연세대 의대 교수 겸임)는 “이번 도출된 임상시험 결과를 토대로 안전성 및 유효성 측면에서 한층 더 확신을 갖고 차단계 임상시험을 적극 추진하겠다”고 전했다.
에스바이오메딕스 관계자는 중증하지허혈 치료제(FECS-Ad)의 차단계 임상시험을 2025년 상반기에 진행할 계획이라고 밝혔다.