루센티스, 물질특허 만료 시작
29일 관련업계에 따르면 제넨텍이 개발한 황반변성 치료제 ‘루센티스’의 물질특허가 작년 6월 미국을 시작으로 내년 7월 유럽에서 만료된다. 다른 황반변성 치료제 ‘아일리아’(리제네론·바이엘 공동개발)도 2023년 6월 미국, 2025년 5월 유럽에서 각각 물질특허가 만료될 예정이다. 루센티스와 아일리아는 작년 전 세계 매출이 각각 4조원, 8조7000억원에 달하는 블록버스터(연매출 1조원 이상) 의약품이다.
|
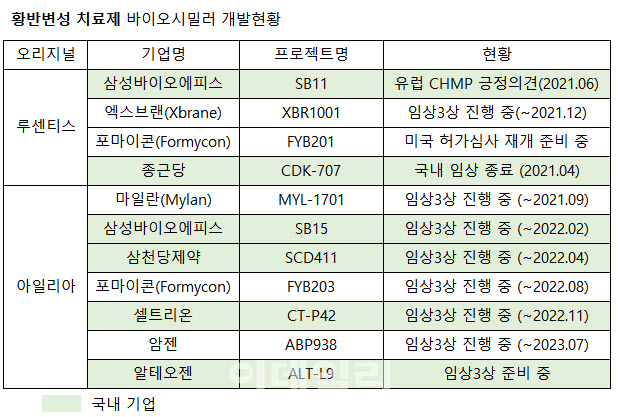
물질특허가 만료되면 바이오시밀러가 시장에서 판매될 수 있다. 현재 루센티스 바이오시밀러는 삼성바이오에피스 ‘SB11’의 개발 단계가 가장 앞서있고 독일 포마이콘의 ‘FYB201’이 임상 종료 후 미국 허가심사 재개를 앞뒀다. 종근당(185750)은 지난 4월 국내 임상을 종료했고 스웨덴 엑스브랜이 연말까지 임상 3상을 진행한다. 물질특허 만료가 상대적으로 여유로운 아일리아는 미국 비아트리스(구 마일란)가 오는 9월 임상 3상을 완료할 예정이라 가장 앞서있다.
국내에서는 삼성바이오에피스, 삼천당제약(000250), 셀트리온(068270)이 임상 3상을 내년 잇따라 마무리하고 알테오젠(196170)은 임상 3상을 준비 중이다. 이외 해외 포마이콘, 암젠도 임상 3상을 진행하면서 시장이 열리길 기다리는 중이다.
국내외 기업들이 황반변성 치료제 바이오시밀러 시장에 뛰어든 것은 시장의 성장성 때문이다. 황반변성은 눈 안쪽 망막 중심부의 신경조직이자 망막에서 빛을 가장 선명하고 정확하게 받아들이는 부분인 황반이 노화, 염증 등으로 기능을 잃으면서 시력에 장애가 생기는 질환이다. 심할 경우 실명에 이를 수도 있다. 병의 주된 원인은 ‘노화’다. 이 때문에 인구 고령화가 가속화되면서 환반변성 환자 수도 급속도로 늘어나는 추세다.
한국보건산업진흥원에 따르면 미국·프랑스·독일·이탈리아·스페인·영국 등 6개국의 노인성 황반변성(습성) 환자 수는 2015년 251만명에서 2035년 387만명으로 늘어날 전망이다. 황반변성은 건성과 습성으로 나뉘는데 시력상실을 유발하는 습성이 노인성 황반변성이다. 환자 수 증가로 황반변성 치료제 시장도 크게 확대될 전망이다. 시장조사기관 글로벌데이터는 미국·유럽 등 주요 9개국의 노인성 황반변성 치료제 시장 규모가 2028년 187억달러(21조원)로 2018년의 두 배가 넘을 것으로 전망했다.
첫 바이오시밀러 ‘삼성에피스’ 유력
문제는 황반변성 치료제 비용 부담이다. 황반변성은 현재 완치가 불가하고 1~2개월 간격으로 꾸준히 치료를 받아야 한다. 하지만 루센티스, 아일리아, 비오뷰(노바티스 개발)등 현존하는 황반변성 치료제 3개는 바이오의약품으로 고가다. 국내만 해도 1바이알(병) 당 가격이 루센티스 82만8166원, 아일리아 75만1493원에 달한다.
이는 효능이 동일하면서 가격은 오리지널보다 통상 30%가량 저렴한 바이오시밀러가 대안으로 떠오른 배경이다. 다만 루센티스, 아일리아의 물질특허가 만료되지 않은 만큼 아직 황반변성 치료제 바이오시밀러는 시장에 없다. 즉 황반변성 바이오시밀러를 처음 출시하는 기업은 오리지널사가 독점한 시장을 적잖이 흡수할 수 있다. 바이오업계 관계자는 “바이오시밀러 시장 특성상 처음으로 진입해 점유율을 차지하는 것이 매우 중요하다”며 “퍼스트무버여야 시장 점유율 차지에 유리하기 때문”이라고 했다.
현재 국내·외에서 ‘첫 황반변성 치료제 바이오시밀러’를 만들어낼 기업으로는 삼성바이오에피스가 유력하다. 삼성바이오에피스는 작년 10~11월 유럽과 미국에서 허가심사에 착수했다. 이어 최근 유럽 의약품청(EMA) 산하 약물사용 자문위원회(CHMP)로부터 황반변성 치료제 ‘루센티스’ 바이오시밀러인 ‘바이우비즈(프로젝트명 SB11·성분명 라니비주맙)’의 판매허가 ‘긍정의견’을 받았다. 삼성바이오에피스 관계자는 “CHMP 긍정의견이 유럽연합 집행위원회(EC) 판단에 결정적인 역할을 한다”며 “2~3개월 후 최종 허가를 받을 수 있을 것”이라고 했다. 최종 허가를 받으면 바이우비즈는 첫 황반변성 치료제 바이오시밀러가 되며 내년 7월 이후 유럽에서도 판매할 수 있다.







![천만원으로 매달 300만원 통장에... 벼랑끝 40대 가장의 '대반전'[주톡피아]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/03/PS26031001803t.jpg)
![서초구 아파트 19층서 떨어진 여성 시신에 남은 '찔린 상처' [그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/03/PS26031100013t.jpg)