|
PHI-101-AML은 인공지능 신약개발 플랫폼 ‘케미버스’를 활용해 도출한 물질로, 기존 승인된 급성 골수성 백혈병의 높은 미충족 수요를 극복하기 위해 계열 내 최고(Best-in-Class) 약물을 목표로 개발 중인 항암제다. 이 후보물질은 AML 환자 중 약 30~35%가 보이는 FLT3 유전자 변이를 표적해 암세포의 성장을 억제한다. FLT3 변이를 보유한 AML 환자는 그렇지 않은 환자 대비 생존율이 약 2배 낮고 재발 위험은 훨씬 큰 것으로 알려져 있다.
이번 학회에서 PHI-101-AML의 확장권장용량인 160㎎ 단일 요법으로 추가 진행한 임상 1b상의 결과와 함께 임상 1상의 최종 환자 모집 완료 후 진행된 종합적인 결과가 발표될 예정이다.
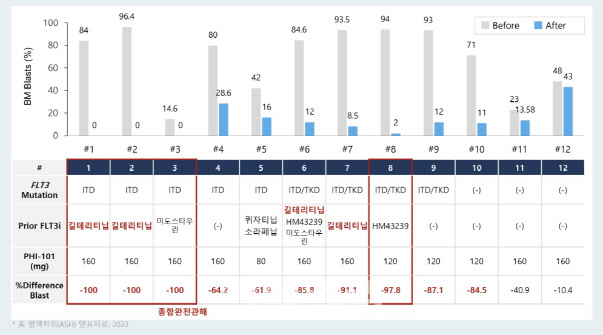
파로스아이바이오가 연구 초록을 통해 공개한 결과에 따르면 임상 1b상은 참여 환자의 75%가 기존 FLT3 저해제 치료 후 재발 또는 불응한 케이스였으며, 평가 가능한 환자의 50%가 종합완전관해(CRc)를 보였다. 종합완전관해란, 완전관해(CR)와 불완전한 혈액학적 회복을 동반한 CR(CRi), 형태학적 백혈병이 없는 상태(MLFS)를 포함한 수치를 말한다.
파로스아이바이오는 연내 PHI-101-AML의 임상 1상을 성공적으로 마무리한 후, 임상 2상 결과에 따라 조건부 품목 허가를 통한 조기 상용화에 나선다는 방침이다. 업계에서는 통상 임상 1상을 신약의 안전성을 확인하는 초기 단계로 보고 있으나, PHI-101은 희귀암을 대상하는 항암제인 만큼 이번 1상 결과로도 유효성을 검증할 수 있을 것이라는 설명이다.
한혜정 파로스아이바이오 최고혁신책임자(CIO) 및 미국 법인 대표는 “PHI-101의 임상 1상을 진행하면서 차세대 FLT3 저해제로서의 우수한 가능성을 지속 확인해 나가고 있다”며 “현재 PHI-101-AML의 임상 1상 마무리와 동시에 글로벌 임상 2상을 위한 IND 신청을 계획 중으로, 하루빨리 희귀질환을 앓고 있는 환자들에게 새로운 치료 옵션을 제공할 수 있도록 연구개발에 박차를 가할 것”이라고 밝혔다.

![삼성전자, 18만원도 뚫었다…사상 최고가 또 경신[특징주]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26021300592t.jpg)


