|
미국 시판 중인 대웅제약의 나보타(수출명 주보)를 제외하고는 실제 미국 시장에 출시된 한국산 보톡스 제품은 없어 국내에 미칠 파장은 제한적일 것으로 분석된다. ITC 예비판정을 통해 유리한 고지를 점한 메디톡신도 한국 식품의약품안전처로부터 판매 금지 처분을 당해 당장 실적 개선은 어려운 상황이다.
다만 미(美) ITC 판정이 갖는 전 세계적 권위에 비춰볼 때 신종 코로나바이러스 감염증(코로나19) 방역과 진단 기술로 재조명된 우리 바이오업계에 대한 신뢰도에는 흠집이 났다는 지적이다. 대웅제약 역시 7일 입장문을 내고 “국내 제약회사가 미국 식품의약국(FDA) 승인을 받아 미국 시장에 진출한 역사적 기록이 훼손돼 안타깝다”고 밝혔다.
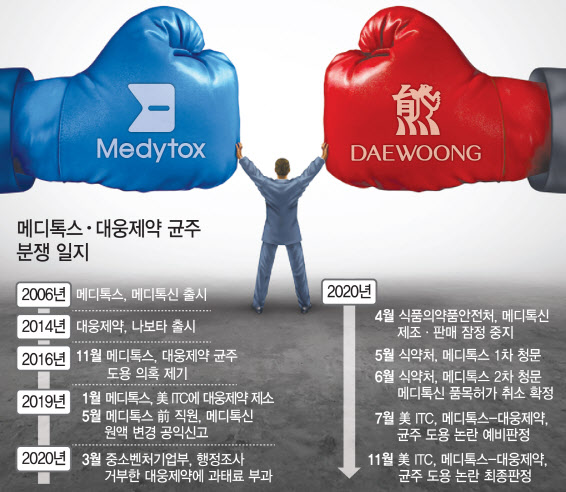
이번 예비판정은 오는 11월까지 ITC 전체위원회 검토를 거쳐 미국 대통령이 승인하면 최종 확정된다. 이로써 4년간 이어진 메디톡스와 대웅제약 균주 분쟁은 종착역에 가까워지고 있다. 대웅제약은 적극적인 소명으로 최종 판결에서는 반드시 승리한다는 입장이다. 특히 이날 대웅제약은 미국 협력사인 에볼루스로부터 4000만 달러 규모의 전환사채를 인수한다고 발표했다. 향후 소송에서 승소할 때를 대비해 더욱 공격적인 마케팅을 전개한다는 계획이다.
|
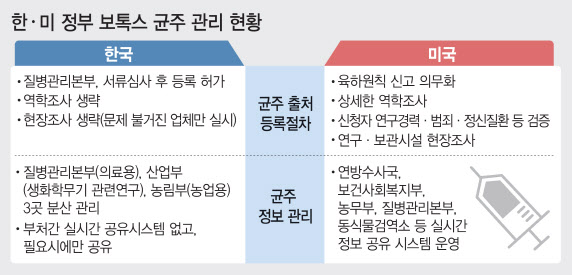
국내 영향이 크지 않다고 해도 균주 출처가 분명한 업체들은 해외 시장에서 높은 프리미엄을 받게 될 것으로 예상된다. 또한 이번 사태를 계기로 식약처 등 관련 부처의 제약·바이오기업에 대한 인허가 심사가 강화될 전망이다.
이미 식약처는 지난달 29일 국무총리령인 ‘의약품 등의 안전에 관한 규칙’ 개정안을 입법예고 하고 다음달 28일까지 한 달간 의견 수렴을 받고 있다. 개정안은 의약품을 제조하면서 제조·품질관리 기록을 거짓으로 작성한 경우 행정처분 기준을 대폭 강화했다. 그동안 제조업무정지 3월·6월과 허가 취소했던 것을 제조업무정지 6월과 허가 취소로 상향했다.
아울러 ‘데이터 완전성 평가지침’이 마련됐다. 품질경영 원칙에 ‘윤리경영’을 반드시 반영하도록 해 서류를 허위·조작·누락하지 않고 기록하게 했다. 지난 3일에는 ‘첨단바이오의약품의 품목허가·심사 규정’ 고시 제정안을 행정예고 하는 등 잇따른 대책들이 나오고 있다. 주요 내용은 장기추적조사 제도를 도입해 치료제 종류와 임상시험 결과 등을 고려, 일정 기간 이상사례 관찰이 필요한 경우 ‘장기추적조사’ 대상으로 지정하고, 조사 기간을 5년 이내~30년 이내로 정할 수 있게 했다. 진홍국 한국투자증권 연구원은 “다른 국가와 비교했을 때 유독 낮았던 국내 보툴리눔 톡신 시장의 진입 장벽은 한층 높아질 것”이라고 내다봤다.