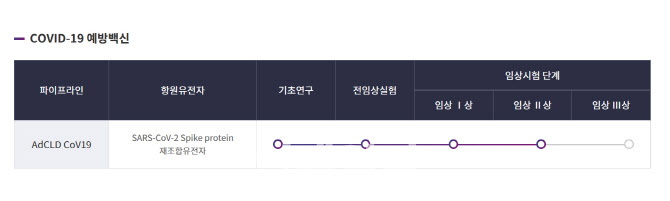
5일 업계에 따르면 셀리드는 전날 식품의약품안전처에서 ‘AdCLD-CoV19-1 OMI’의 임상 1·2상 계획을 승인받았다.
셀리드 관계자는 “기존에 임상 중인 ‘CoV19-1’의 경우 최초 접종자를 위한 것으로, 개발이 완료되면 동남아시아와 아프리카 등 중저소득 국가를 중심으로 공급이 되는 것”이라며 “이번에 임상 계획을 승인받은 ‘CoV19-1 OMI’의 경우 부스터샷 용도로 국내·외 최초 접종을 한 이를 대상으로 하기 때문에 시장이 다르기 때문”이라고 설명했다.
|
셀리드가 먼저 개발중이던 앞서 우한 바이러스에 대응하는 ‘CoV19-1’은 최근 국내 임상2b상의 투약을 시작했다. 해외 임상은 국제백신연구소와 진행을 하고 있다. ‘CoV19-1’는 국내에 도입되기도 했던 존슨앤존슨(JNJ)의 얀센 백신처럼 단회 접종 백신이다. 다만 이번 2b상에서는 부스터샷 효능을 확인하기 위해 단회와 2회 접종을 동시에 추진한다.
|
셀리드는 지난 2006년 12월에 설립된 항암면역치료 백신을 개발하는 바이오테크다. 아데노 바이러스 벡터 플랫폼 기술을 가지고 있다.
셀리드 관계자는 “셀리드 플랫폼은 바이러스 벡터에 효력이 높은 항원을 개발해서 탑재하면 되는 것”으로 “빠르게 항원을 개발할 수 있는 능력을 확보하고 있는 것이 셀리드의 강점이다. 앞으로 사용허가를 받게 되면 새롭게 나오는 변이에 빠르게 대응할 수 있을 것으로 보고 있다”고 말했다.