|
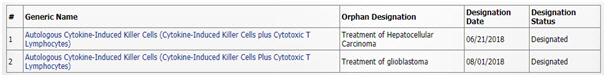
이뮨셀-엘씨는 2007년부터 국내 간암 항암제로 식품의약품안전처 품목허가를 얻어 생산·판매 중이다. 이번 희귀의약품 지정은 지난 6월 미국 간암에 이어 두 번째다.
회사는 2008년부터 뇌종양(교모세포종) 환자 180명에 대한 3상 임상시험을 진행하고 결과를 2016~2017년 논문(Oncotarget, Immunotherapy)에 발표한 바 있다.
FDA 희귀의약품 지정(ODD)은 희귀난치성 질병이나 생명을 위협하는 질병의 치료제 개발·허가가 원활하게 이뤄지도록 지원하는 제도다. 희귀의약품으로 지정된 치료제는 세금 감면, 신약승인 심사비용 면제, 시판허가 승인 후 7년간 독점권 인정 등 혜택이 부여된다.
‘이뮨셀-엘씨’는 환자 자신 혈액을 원료로 만드는 개인별 맞춤 항암제다. 약 2주간 배양 과정을 통해 항암기능이 극대화된 강력한 면역세포로 제조해 환자에게 투여하는 방식이다. 회사는 추가로 췌장암에 대한 희귀의약품 지정도 신청해 결과를 기다리고 있다.
이뮨셀-엘씨 외에도 차세대 세포치료제 ‘CAR-T’를 개발하고 있다. 환자 T세포를 체외에서 조작해 암세포 표면의 특정 단백질 항원을 인식하는 CAR를 면역세포 표면에서 생성, 환자에게 주입해 암세포만을 정확하게 공격하는 면역세포치료제다.
회사는 셀 센터를 신축해 매출이 급증하는 이뮨셀-엘씨 생산시설을 확충하고 차세대 세포치료제 CAR-T 등 신제품 개발을 위한 인프라 구축을 추진 중이다. 셀 센터는 내년말 우수의약품제조관리기준(GMP) 인증을 목표로 하고 있다.
이득주 사장은 “미국 임상시험을 최소화해 비용과 시간을 절약하고 성공적으로 미국 시장에 진출하기 위한 전략을 구상 중”이라며 “이번 희귀의약품 지정을 통해 이뮨셀-엘씨의 미래가치를 인정받아 유리한 조건으로 FDA 허가를 받을 수 있을 것”이라고 말했다.