주사제는 제네릭을 개발할 때 사람을 대상으로 하는 임상시험이 필요없었다. 하지만 제약사들이 이번에 처음으로 개발에 뛰어드는 먹는 항암제의 제네릭은 임상시험을 진행해야만 허가받을 수 있다.
27일 업계에 따르면 식품의약품안전청은 최근 항암제 6개 제품의 생물학적 동등성시험 가이드라인을 신설, 제약사들에 제시했다. 제네릭의 경우 약물이 혈액내로 들어오는 농도가 오리지널과 동등함을 입증하는 생물학적 동등성시험(생동성시험)을 통과하면 식약청으로부터 시판 허가를 받을 수 있다.
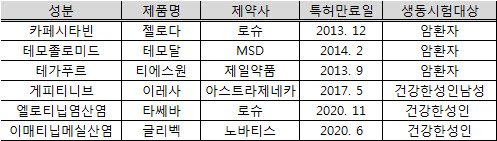
식약청은 해외 사례 등을 검토한 결과 '젤로다'(성분명 카페시타빈), '테모달'(성분명 테모졸로미드), '티에스원'(성분명 테가푸르) 등 3개 제품은 암환자에 대한 관리가 가능한 생동성시험기관에서 실제 암 환자를 대상으로 생동성시험을 진행토록 권고했다.
|
다만 부작용 발생비율이 낮은 '이레사', '타쎄바', ‘글리벡' 등은 생동성시험을 건강한 성인이나 성인남자를 대상으로 실시하는 것을 허용했다.
2013년부터 일부 경구용 항암제의 특허 만료가 예정되자 제약사들은 새로운 먹거리 창출 차원에서 항암제 제네릭 개발에 뛰어들려 채비를 하고 있다. 제약사 입장에서는 실제 암 환자를 대상으로 생동성시험을 해야 하는 약물의 경우 제네릭 개발에 빨간불이 켜졌다.
실제 암 환자 모집에 적잖은 시간과 비용이 소요된다는 점이 항암제 제네릭 개발에 가장 큰 걸림돌이다. 암 환자들이 검증되지 않은 제네릭을 치료약으로 선택토록 하는 것도 쉬운 일은 아니다.
건강한 사람을 대상으로 실시하는 경우에도 세포 독성이 있는 항암제의 경우 탈모와 같은 심각한 부작용이 우려돼 건강한 성인에게 투여하는 것은 윤리적으로 문제가 있다는 지적이 나오고 있다.
국내사 개발담당 한 임원은 "윤리적인 이유로 항암제 제네릭 개발 요건을 엄격하게 설정하는 것도 필요하다"면서도 "실제 암 환자를 대상으로 생동성시험을 하는 것이 쉽지 않아 업체마다 제네릭 개발을 포기하려는 움직임도 눈에 띈다"고 말했다.