|
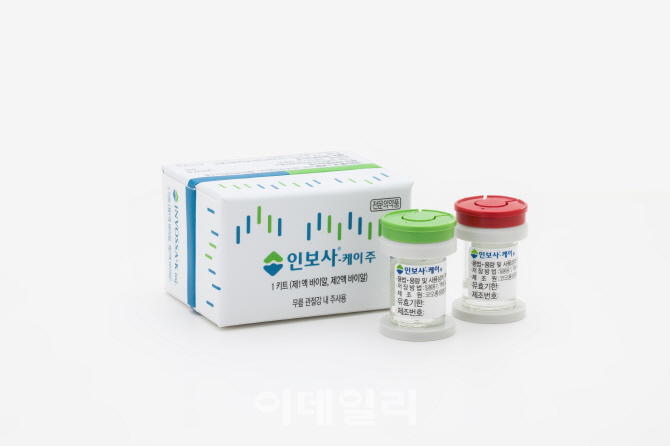
식품의약품안전처는 인보사 주성분 2액이 연골유래세포가 아님에도 이를 연골유래세포로 품목허가 신청해 허가를 받았지만 허가내용과 달리 신장유래세포를 이용해 인보사를 제조했고, 이는 안전성과 유효성이 충분히 확보되지 않은 상황이라 국민 보건에 위해를 줄 우려가 있다며 허가 취소 이유를 밝혔다.
허가 취소는 7월 9일자다.
인보사는 연골세포와, 연골의 성장을 돕는 성장인자 등 2종류의 약으로 구성됐다. 제조사인 코오롱생명과학(102940)은 성장인자를 연골유래세포로 만든다고 허가서류에는 기재했지만 신장유래세포로 만들었다는 게 밝혀졌다. 코오롱생명과학 측은 지난달 18일 열린 청문회에서 “고의로 자료를 조작한 게 아니고 세포가 바뀌었어도 안전성과 유효성은 변하지 않았다”고 주장한 바 있다.
코오롱생명과학 측은 행정법원에 효력정지 가처분 신청을 제기하는 등 법적 대응을 이어갈 것으로 알려졌다.

![할머니에 욕정 품은 그놈…교회로 향한 이유는 [그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24122300012t.jpg)
![40년간 아무도 예상치 못한 AI 붐에 대비한 '이 사람'[파워人스토리]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24122300015t.jpg)

