휴미라 바이오시밀러의 시장 점유율이 아직 대세에 큰 영향을 미칠 수준은 아니지만, 처방약급여관리업체(PBM)를 늘려가면서 점유율에 변화가 생기고 있다는 점에서는 충분히 의미가 있는 것으로 분석된다.
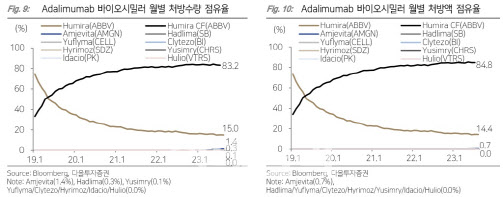
19일 다올투자증권에 따르면 지난달 미국의 아달리무맙 성분 바이오의약품 시장에서 오리지널 제품인 애브비 ‘휴미라’는 처방 수량 기준 98.2%의 점유율을 기록했다. 이는 휴미라 바이오시밀러가 본격적으로 출시된 첫 달인 지난 7월 99% 보다 다소 줄어든 수치다.
오리지널의 빈자리는 바이오시밀러 제품들이 차지했다. 지난 7월 1.0%였던 아달리무맙 바이오시밀러 처방 수량 점유율은 8월 1.8%로 증가했다. 휴미라의 미국내 지난해 연 매출액은 24조원 규모로, 올해 바이오시밀러 출시에 약 4300억원 가량의 매출이 빠진 셈이다.
아직 오리지널 제품 휴미라의 독주가 이어지고 있지만, 바이오시밀러 업체들의 미국 시장 공략 핵심인 PBM 목록 등재 증가와 가격 경쟁력 등의 강점을 바탕으로 바이오시밀러의 공세가 더욱 거세질 것으로 예상된다.
|
삼성바이오에피스는 7월 출시 이후 미국 보험사 및 처방약급여관리업체(PBM)의 처방집 등재를 통한 처방 확대 전략을 펼치고 있는데, 시장 점유율을 늘리면서 초반 PBM 공략의 효과를 누리는 것으로 분석된다.
PBM은 처방약의 관리 업무를 전문적으로 대행하는 업체로, PBM 목록에 등재되는 것은 미국의 의료보험 급여 체제에 들어가 본격적인 처방이 이뤄지는 것을 의미한다.
삼성바이오에피스의 휴미라 바이오시밀러 ‘하드리마’는 지난 7월 출시 첫 달 시장 점유율 0.1%를 기록하면서 본격적인 시장 진출을 알렸다. 8월에는 시장 점유율이 0.3%로 소폭 상승했다. 이는 올해 1월 휴미라 퍼스트 바이오시밀러로 출시된 암젠의 ‘암제비타’ 1.4%에 이어 바이오시밀러 중에서는 2위에 해당한다.
점유율이 크지는 않지만 다른 바이오시밀러보다 먼저 출시되면서 크게 주목을 받았던 ‘암제비타’가 6월까지 0.3%의 점유율 밖에 기록하지 못했다는 점에 비춰본다면 의미있는 수치라 할 수 있다.
하드리마는 출시 첫달인 올해 7월 미국 대형 보험사 ‘시그나헬스케어’의 처방집에 이어 중소형 PBM ‘프라임테라퓨틱스’에 선호 의약품으로 등재됐다. 업계에서는 이를 통해 바이오시밀러 시장에서 20% 가량을 차지하는 판로를 확보한 것으로 보고 있다.
또 미국 판매 파트너사인 오가논에 따르면, 하드리마는 미국 대형 보험사인 ‘유나이티드 헬스케어’ 처방집에도 등재됐다. 저소득층 케어 중심의 보험사 ‘센틴’으로부터도 보험 등재를 통지 받은 것으로 전해진다. 센틴은 미국내 가입자가 500만명 수준으로, 민간 보험시장에서 10%를 차지하는 것으로 알려져 있다.
삼성바이오에피스 관계자는 “아직 휴미라 바이오시밀러 시장 형성 단계이기 때문에 지속적으로 여러 PBM과 목록 등재를 협의 중”이라며 “최대한 환자 접근성 확대를 위해 노력 중에 있다”고 말했다.
셀트리온은 출시 첫 달에 이어 8월에도 아달리무맙 시장 처방 수량 점유율에서 0.0%를 기록했는데, 지난달 말 PBM와 첫 계약을 체결하고 미국 공보험 처방집 선호의약품(preferred drug)에 유플라이마를 등재하면서 본격적인 처방이 기대된다.
유플라이마 판매 담당인 셀트리온헬스케어와 계약을 맺은 PBM는 미국의 거대 민간보험사 유나이티드헬스케어 산하 ‘옵텀’이다. 옵텀은 미국 처방시장의 80%를 차지하는 미국 3대 PBM이며, 공보험에서 가장 큰 규모를 보유하고 있다.
셀트리온은 이밖에 여러 PBM과 협의를 진행 중이며 20%의 시장 점유율을 기대한다. 셀트리온 관계자는 “PBM 등재 절차가 이달 내로 마무리 될 것으로 보이며 이르면 이달부터 보험 처방이 이뤄질 것”이라고 설명했다.
◇상호교환성 승인시 점유율 확보 ‘가속’ 기대
삼성바이오에피스와 셀트리온은 PBM 등재 수를 늘리는 것 이외에 ‘상호교환성’ 승인을 통한 점유율 가속도 기대 중이다.
상호교환성(IC) 임상은 오리지널 바이오의약품과 바이오시밀러가 동등한 약인지 검증하는 실험으로, 이를 통해 승인 받으면 약국에서 약사의 처방으로 오리지널 의약품을 대체할 수 있다.
현재는 베링거인겔하임의 휴미라 바이오시밀러 ‘실테조’가 상호교환성 승인을 받은 상태다. 베링거인겔하임은 올해 7월 상호교환성 승인을 획득하면서 독점 기간 1년을 보장받았다. 다른 업체들은 내년 7월 이후에 상호교환성 승인이 가능하다.
삼성바이오에피스의 미국 파트너사 오가논은 이미 상호교환성 바이오시밀러 지위를 획득하기 위한 추가 임상시험을 종료한 상태로, 내년 7월 베링거인겔하임 실테조의 독점 기간이 끝나면 즉시 승인을 추진한다는 방침이다.
셀트리온 유플라이마 역시 내년 여름 상호교환성 확보를 목표로 글로벌 임상 3상을 진행하고 있다.
이밖에 미국 휴미라 시장의 85%를 차지하는 것은 고농도 제품인데, 고농도 휴미라 바이오시밀러는 하드리마, 유플라이마, 하이리모즈(산도즈) 3개 품목밖에 없다는 점에서도 점유율 확대 기대를 높이는 중이다.
업계 관계자는 “상호교환성 임상과 고농도에 이어 통증과 연관이 있는 구연산염 제거 제품을 보유한 곳은 삼성바이오에피스와 셀트리온 두 곳 뿐으로 점유율 확보는 시간 문제”라고 말했다.
![[르포]“이렇게 많이 올 줄은”…`폭설 첫눈`에 시민들 출근길 발 동동](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112700623t.jpg)



