연세암병원 종양내과 홍민희 교수와 강남세브란스병원 종양내과 이서영 교수 연구팀은 확장기 소세포폐암 1차 치료제에 관한 기존 연구 결과를 후향적으로 평가한 결과 치료제가 환자의 이질성에 상관없이 효과를 보인다고 6일 밝혔다. 이번 연구 결과는 암 면역학·면역치료(Cancer Immunology, Immunotherapy) 최신 호에 게재됐다.
폐암은 세계적으로 가장 빈번하게 진단되는 악성 종양 중 하나이자 사망률 1위의 암이다. 소세포폐암은 악성도가 심해 사망률이 특히 높지만, 전체 폐암 중 15% 정도에 그쳐 비소세포폐암과는 달리 세포독성 항암제나 방사선 외에 치료법의 발전이 없었다.
사멸 단백질 1(PD-1) 억제제 니볼루맙과 펨브롤리주맙이 일부 환자에서 효과를 보이면서 면역항암제 단독으로 소세포폐암 치료에 사용되기 시작했다.
이후 기존 치료제인 세포독성 항암제에 면역항암제를 결합한 3상 임상이 진행됐다. 확장기 소세포폐암 환자 403명을 대상으로 세포독성 항암제인 에토포사이드, 카보플라틴에 면역항암제인 아테졸리주맙을 추가한 군과 위약을 추가한 군으로 나누어 투약했다.
그 결과 아테졸리주맙 군의 무진행 생존 기간 중앙값과 전체 생존 기간 중앙값은 각각 5.2개월과 12.3개월로, 위약 군의 무진행 생존 기간 4.3개월, 전체 생존 기간 중앙값 10.3개월 보다 유의하게 높았다. 이런 임상 연구 결과를 바탕으로 미국 식품의약국 FDA는 아테졸리주맙, 에토포사이드, 카보플라틴을 소세포폐암 1차 치료제로 승인했다. 하지만 글로벌 3상 임상의 대상 환자 중 아시아인의 비율이 14~22%에 불과해 임상 결과의 보편적 적용 가능 여부를 확인하기 어려웠다.
홍민희·이서영 교수 연구팀은 한국인을 임상 대상으로 설정해 아테졸리주맙, 에토포사이드, 카보플라틴 병합 투약의 효능과 안정성에 관한 후향적 연구를 진행했다.
|
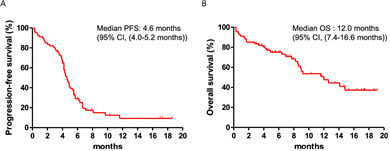
연세암병원에서 아테졸리주맙, 에토포사이드, 카보플라틴을 처방받은 확장기 소세포폐암 환자 68명을 11.6개월간 추적 관찰한 결과 무진행 생존 기간 중앙값은 4.6개월, 전체 생존 기간 중앙값은 12.0개월로 기존의 3상 임상시험과 비슷했다. 또한 뼈 전이, 면역 관련 이상 반응, 젖산탈수소효소(LDH) 상승 여부가 소세포폐암 환자의 전체 생존 기간에 나쁜 영향을 미친다는 것도 확인했다.
홍민희 교수는 “이번 연구를 통해 확장기 소세포폐암 환자에 대한 세포독성 항암제와 면역항암제 병합 투약의 효과와 안정성을 실제 임상 데이터로 재확인했다”며, “나쁜 예후 인자로 작용하는 요소들도 파악함에 따라 이번 연구 결과가 추후 소세포폐암 치료제 개발에 큰 도움이 될 것으로 기대한다”고 말했다.


![공연 취소 당한 이승환, 구미시장에 손배소[전문]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24122401045t.jpg)

