|
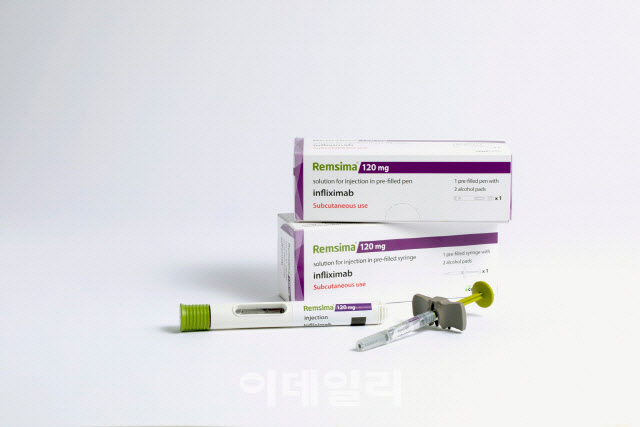
램시마SC는 셀트리온이 개발한 자가면역질환 치료용 바이오시밀러 램시마(성분명 인플릭시맙)를 정맥주사(IV) 제형에서 피하주사(SC) 제형으로 바꾼 제품이다. 정맥 속에 바늘을 찔러 약물을 주입하는 제형에서 피부 아래 조직에 소량을 투약하는 제형으로 변경한 것이다. 투약 시간이 짧고 병원에 갈 필요 없이 환자가 직접 투여할 수 있는 장점이 있다.
이번 판매 허가는 셀트리온이 지난해 2월 램시마SC에 대한 허가를 신청한 지 1년 만에 나온 결과다. 캐나다 보건청은 EMA에 셀트리온이 제출한 방대한 임상 데이터를 인정해 ‘바이오베터(Biobetter)’ 형태로 허가 심사를 진행했다. 제약업계는 캐나다가 의료 재정 절감을 위해 바이오시밀러에 대해 우호적인 정책을 펴고 있어 이번 허가가 조속히 이뤄졌고 이후 시장 진입도 순조로울 것으로 보고 있다. 셀트리온은 자회사인 셀트리온헬스케어를 통해 현지에 의약품을 판매할 예정이다. 회사가 추산하는 캐나다 자가면역질환 치료제 시장 규모는 2조원이다.
캐나다를 시작으로 북미 지역 전체에서 판매 허가를 받게 되면 잠재적인 시장 규모는 더욱 커질 전망이다. 북미 지역의 자가면역질환 치료제 티엔에프알파(TNF-α) 억제제 시장은 42조원 규모로 추산된다. 미국 식품의약국(FDA)에서는 램시마SC를 ‘신약’으로 판단, 셀트리온은 FDA와의 협의 하에 1·2상 임상을 면제받고 2019년 7월부터 임상 3상을 진행 중이다.
앞서 셀트리온은 2019년 EMA로부터 판매 승인을 받고 독일, 영국 프랑스 등 주요 5개 국가 출시를 진행하고 있다. 지난해에는 류마티스 관절염(RA)에 이어 염증성 장질환(IBD)에 대한 추가 적응증 승인을 받기도 했다.

![‘297억' 올해도 가장 비싼 집…알고보니 ‘회장님댁'[누구집]](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010500059t.jpg)
![스포츠 센터 엽기 막대 살인...최종 형량은 [그해 오늘]](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010400307t.jpg)
![일에선 프로인데 왜 사랑은 이모양일까..나쁜 X[툰터뷰]](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010500037t.jpg)
