셀트리온, 트룩시마·허쥬마 이은 항체 항암 신약 출시 파란불
셀트리온(068270)이 항암제 ‘아바스틴(성분명 베바시주맙)’의 복제약(바이오시밀러)으로 개발한 ‘CT-P16’이 임상 3상에서 아바스틴과 같은 효능을 보였다고 13일 밝혔다.
회사는 8일부터 13일(현지 시각)까지 미국 뉴올리언스에서 열린 미국암연구학회(AACR)에서, CT-P16이 오리지널의약품 간 객관적반응률(종양 크기가 줄어드는 정도를 나타낸 수치)이 동등성 입증을 위한 최소치를 만족했다고 발표했다.
이번 3상은 비소세포폐암 환자 689명을 두 집단으로 나눠 진행됐다. 환자들은 각각 CT-P16과 아바스틴을 병용 항암제와 함께 3주에 한 번씩 최대 6회까지 병용 투약했다. 그 이후에는 최대 3년 동안 병용 항암제 없이 CT-P16과 아바스틴 단독 투약했다.
|
아바스틴은 스위스 제약사 로슈가 개발한 블록버스터 항암제다. 비소세포폐암·전이성 직결장암·전이성 유방암·교모세포종 등 치료에 사용된다. 지난해 글로벌 매출은 약 4조원(30억5000만 스위스 프랑)이었다.
셀트리온은 이번 임상 3상 결과를 토대로 아바스틴에 승인된 전체 적응증에 대해 한국·미국·유럽 등에 CT-P16 품목허가 신청을 완료했다. 향후 CT-P16이 출시되면 셀트리온은 혈액암 치료제 트룩시마와, 유방암 치료제 허쥬마에 이어 세 번째 항암 항체 복제약을 확보하게 된다.
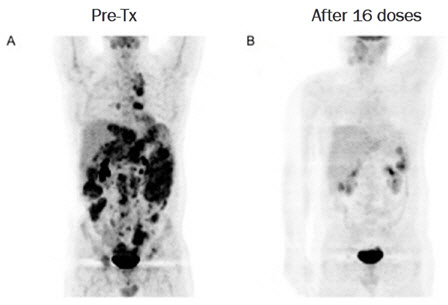
엔케이맥스, “육종암 말기 환자 완전 관해”
엔케이맥스(182400)는 미국 자회사 엔케이젠바이오텍이 동정적 사용 승인을 통해 치료를 진행한 육종암 말기 환자에게서 암이 완전히 사라진 것으로 나타났다고 14일 밝혔다. 앞서 회사는 지난해 12월 이 환자의 간에 발생한 종양이 약 80% 관해 됐다고 공개한 바 있다.
이 환자는 2017년 육종암 판정을 받을 당시 간·폐·복부·방광 등 전신에 암이 전이된 상태였다. 슈퍼NK 투약 전 약 1년 반 동안 화학치료제 및 면역항암제를 투여했으나 독성 반응이 나타나고 암이 계속 커져 치료를 중단했다. 특히 이 환자는 PD-L1 발현율이 음성이었다. 전체 암 환자 중 25~30% 만이 PD-L1 양성 환자이고 70~75%는 PD-L1 음성 환자로 알려져 있다.
|
이후 이 환자는 동정적 사용 환자로 등록돼 28개월 동안 총 30회 슈퍼NK와 키트루다를 병용투여 받았다. PET-CT 검사 결과 잔존 종양이 존재하지 않는 것으로 관찰돼, 완전 관해(CR, complete response) 상태에 도달했다는 것이 회사 설명이다.
김혜련 연세암병원 종양내과 교수는 “말기 육종암은 치료가 매우 어렵고 예후가 좋지 않은 게 현실”이라며 “육종암은 희귀성 난치암이라 효과적인 치료제가 아직 개발돼 있지 않다. 수술요법·방사선요법·화학요법을 삼중병용하는 게 유일한 표준치료 방법이다”라고 말했다.
이어 김 교수는 “PD-L1 발현이 거의 없는 음성인 환자에게서 치료반응이 보인 것은 드문 사례”라며 “만약 슈퍼NK가 이러한 PD-L1 음성 환자군을 양성 환자로 변화시킬 수 있다면 암 치료제 시장의 큰 변화를 끌어낼 수 있을 것”이라고 밝혔다.




!['과대망상'이 부른 비극…어린 두 아들 목 졸라 살해한 母[그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26021700001t.jpg)
