이번 특허는 인간 유전체 내 반복서열로 존재하는 현미부수체의 불안정성(Microsatellite Instability, MSI)를 PNA 프로브로 탐지해 실시간 중합효소연쇄반응(real-time PCR)을 통해 유전자 변이를 검출하는 원천기술 및 관련 제품에 관한 독점권을 아우르는 것이다. 특히 세계 유일의 실시간 PCR 기반 MSI 검사 제품으로 기술의 진보성과 신규성을 높게 평가받아 특허 등록이 결정됐다.
PNA 프로브는 인조 DNA로 만든 탐침으로서 현미부수체를 현존하는 최고 정확도로 잡아낼 수 있다. 현미부수체는 1~6개 염기쌍으로 이뤄진 짧은 염기서열이 반복되는 유전체(DNA)의 일부로 전체 DNA의 5% 정도를 차지한다. DNA를 복제할 때 이 구간에서 실수가 빈번하게 일어나는데 불일치 오류를 복구하는 단백질이 없거나 복제 오류를 바로잡는 기능에 문제가 생기면 짧은 염기서열의 반복횟수가 정상보다 적거나 많아져 돌연변이를 초래할 수 있다.
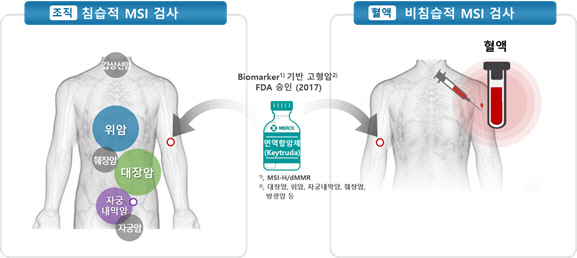
현재 MSI 검사는 주로 비용종증 대장암의 보조 진단에 사용되고 있으며 위암, 자궁내막암, 난소암 등에서 종양 특이적으로 흔히 발견된다. 최근 악성흑색종, 폐암, 유방암, 전립선암, 갑상선암 등에서도 MSI가 확인됨에 따라 개인맞춤형 치료를 구현하는 기초수단이 될 전망이다.
특히 미국 식품의약국이 2017년 5월 MSI-H(고빈도 현미부수체 불안정성)이면서 절제가 불가능하거나 또는 전이성 고형암 2차 단독치료에 미국 머크(MSD)사의 면역항암제 ‘키트루다’(성분명 펨브로리주맙)를 처방할 수 있도록 허용하면서 MSI-H 진단기준에 대한 관심도가 높아졌다. 종양이 발현된 부위가 아니라 종양의 유전적 특성을 바탕으로 처방 적응증을 확정해준 것은 이것이 세계 첫 사례였기 때문이다. 이런 분위기에 힘입어 암종별 개인별 특성에 맞춰 치료제를 선별하는 데 MSI 검사의 활용 범위가 넓어질 전망이다.
시선바이오 측은 “MSI 분별 특허기술은 이미 PCT 국제출원을 마친 상태로 심사 중인 중국과 베트남이 특허 등록을 앞두고 있으며 미국, 유럽 등에서 무난한 등록이 예상된다”며 “2017년 국내 식품의약품안전처 품목허가 및 CE 인증을 받은 후 국내 시장에 성공적으로 데뷔했고 최근 미국, 그리스, 이탈리아 등에서도 러브콜을 받고 수출에 들어갔다”고 밝혔다.
박희경 대표는 “MSI 검사를 자궁내막암과 난소암 선별에까지 확대 적용하는 허가 심사를 받기 위해 임상시험을 진행 중”이라며 “조직 기반의 MSI 검사를 혈액 기반으로 넓히기 위한 제품도 조만간 개발돼 조직검사가 어렵거나 전이성 암을 조기 진단하는 데 활용될 수 있을 것”이라고 기대했다. 혈액검사는 안전하고 간편하며 암 검진에 대한 경제적 시간적 부담을 줄일 수 있는 데다가 암의 조기 진단 및 치료에 이바지할 수 있다.
|