|
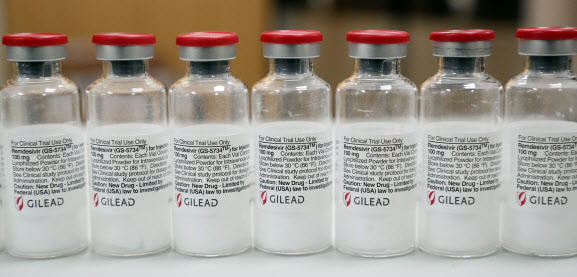
5일(현지시간) 로이터통신에 따르면 유럽연합(EU) 집행위원회는 지난 3일 렘데시비르에 대해 조건부 판매 승인을 했다. 이번 결정으로 렘데시비르는 EU 차원에서 코로나19 치료를 위해 승인한 첫 번째 약이 된다.
렘데시비르는 미국 제약사 길리어드 사이언스의 항바이러스제다. 애초 에볼라 치료제로 개발됐지만 최근 미국에서 진행된 초기 임상시험에서 코로나19 환자의 회복 기간을 31% 줄였다는 발표가 나왔다.
현재 미국과 한국 등에서는 이미 중증 환자에 한해 렘데시비르가 코로나19 치료에 사용되어 왔다. 최근 미국 식품의약국(FDA)는 코로나19 중증 입원환자에게 렘데시비르를 사용할 수 있다고 승인했다. 한국에서도 지난 1일부터 폐렴을 앓으면서 산소 치료를 받고 있는 중증환자에게 렘데시비르를 투약했다.
유럽의약품청(EMA)도 렘데시비를의 긴급 승인을 권고했다.
지난달 25일 EMA는 산소 공급이 필요한 폐렴 증세를 보이는 성인과 12세 이상 청소년의 코로나19 치료에 조건부로 렘데시비르 사용 승인을 권고했다. EU 집행위는 일주일 만에 권고를 받아들였다.
한편 미국이 9월 말까지 렘데시비르 물량의 92%를 확보했다는 소식이 전해지면서 다른 국가에서 해당 약 확보에 대한 우려가 나오고 있다.
한국 질병관리본부는 렘데시비르 수입자인 길리어드 사이언스 코리아와 국내 도입 협의를 통해 의약품 무상 공급을 체결하고 지난 1일부터 국내 공급을 시작했다. 코로나19는 1급 감염병으로 지정돼 감염병 예방법에 따라 치료비용은 전액 국가가 부담한다. 렘데시비르 비용 역시 국가 부담이다.
EU는 최근 27개 회원국을 위한 렘데시비르 확보를 위해 길리어드 사이언스와 협상 중이다.
EU의 조건부 판매 승인은 코로나19와 같이 공중보건을 위협하는 비상 상황에 신속히 대응하기 위한 절차로, 약의 효능과 부작용에 대한 모든 필요한 정보가 확보되기 전에 27개 회원국에서 1년간 의약품이 판매될 수 있도록 하게 한다.
![[단독]SNS 성범죄 증거 삭제 막는다…'불법 영상물 보전명령 도입'](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112900101t.jpg)

!["성관계 요구 알려질까"…십년지기 숨지게 한 일가족[그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112900003t.jpg)

