|
업계에 따르면 수면장애치료제의 전 세계 시장 규모는 약 30억달러(약 3조 4000억원)에 이르며 매년 6~10%씩 성장한다. 업계에서는 재즈의 기술력과 마케팅 능력이라면 수노시가 충분히 승산이 있다고 내다보고 있다. 수노시는 임상시험에서 주간 졸림증 개선 효과가 재즈의 기존 치료제인 ‘자이렘’보다 2배 이상의 효과를 보였다.
수노시는 SK바이오팜에게는 상용화까지 마친 첫 제품이라는데 의의가 있다. SK가 신약개발에 뛰어든 것은 1993년이다. 당시 SK는 대덕연구원 연구·개발(R&D) 조직 안에 신약개발연구팀을 만들었다. 처음부터 SK의 목표는 국내가 아닌 글로벌 시장이었다. SK는 국내 최초로 FDA의 임상시험 승인을 받기도 했다. 항우울제인 ‘YKP10A’가 주인공인데, 이 약은 2000년 글로벌 제약사인 얀센에 기술수출하기도 했다. 2007년 SK가 지주사로 전환하면서 신약개발사업부 이후 2011년 SK바이오팜으로 분사했다.
FDA로부터 임상시험 승인을 가장 많이 받은 국내 제약사도 SK바이오팜이다. SK바이오팜은 FDA로부터 총 16개의 임상시험 승인을 받았다. 업계 관계자는 “그동안 제약업계에서 ‘SK’하면 SK케미칼을 떠올렸으며, SK바이오팜은 존재감이 없었다”며 “가시적 성과가 없어도 25년간 끊임 없이 R&D에 투자했다는 것만으로도 의미는 충분하다”고 말했다.
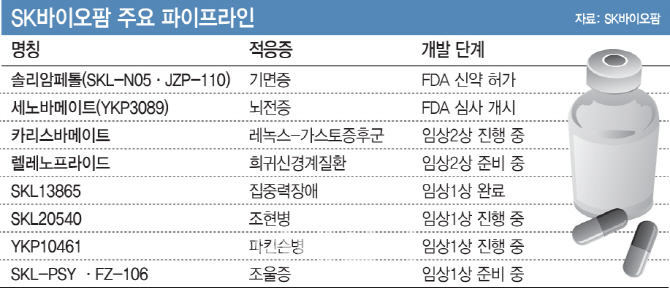
업계에서는 그동안 R&D 노하우가 쌓인 만큼 SK바이오팜의 신약개발이 충분히 경쟁력을 갖춘 것으로 평가한다. SK바이오팜은 중추신경계와 항암제에 주력하는데 현재 공개한 신약 파이프라인이 8개로 대부분 중추신경계 치료제다.
수노시에 이어 상용화 가능성이 높은 것은 뇌전증 치료제 ‘세노바메이트’다. 이 약은 임상3상을 마치고 지난해 말 FDA에 신약허가신청서를 제출해 놓은 상태로 이르면 올해 말 허가를 받아 2020년 상반기 미국에서 출시될 예정이다. 이외에도 희소질환인 레녹스-가스터증후군(소아뇌전증의 일종), 조현병, 파킨슨병, 조울증 치료제를 개발 중이다.
특히 세노바메이트는 국내 제약사가 독자적으로 개발해 FDA의 허가신청까지 마친 첫 신약이다. SK바이오팜 관계자는 “세노바메이트는 후보물질 도출부터 임상시험, 허가까지 기술이전이나 공동개발이 아닌 독자적으로 개발한다는 데 의의가 있다”며 “개발 실패 시 위험은 크지만 상용화에 성공하면 파트너사와 수익을 나누지 않기 때문에 부가가치가 크다”고 말했다.
SK바이오팜은 미국 내 판매도 직접 할 계획이다. 이를 위해 미국 현지에 SK라이프사이언스라는 법인을 운영 중이다. 후발주자에 현지 인지도가 전무해 결코 쉬운 일은 아니다. 이에 대해 또 다른 업계 관계자는 “기술이전을 하는 이유가 상용화까지 드는 막대한 비용과 실패가능성을 줄이려는 것”이라며 “개발부터 판매까지 독자적으로 한다는 것은 최고 의사결정자의 의지가 없다면 불가능하다”고 말했다.
실제로 최태원 SK 회장은 1998년 회장에 취임하면서 R&D에 힘을 실어줬고 수 십년을 투자해도 성공이 담보되지 않은 제약업의 특성을 충분히 이해했다. 한 제약사 연구담당 임원은 “많은 대기업 계열 제약사들이 단기간 성과를 바탕으로 부침을 겪거나 사라지는 것과 달리 SK는 성과와 상관 없이 한우물을 팠고 결국 결실을 맺은 것”이라고 말했다.
최 회장은 제약·바이오산업을 제2의 반도체로 육성한다는 계획을 수차례 내비쳤다. 지난 2017년에는 의약품 위탁생산(CMO) 전문인 SK바이오텍이 아일랜드 BMS의 의약품 공장을, 지난해 7월에는 미국 의약품 위탁개발 및 생산(CDMO) 전문인 엠펙을 인수했다. 아시아, 유럽, 미국에 의약품 생산거점을 갖춘 것으로 세노바메이트는 허가 후 엠펙에서 생산할 것으로 예상된다.
|

![[단독]SNS 성범죄 증거 삭제 막는다…'불법 영상물 보전명령 도입'](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112900101t.jpg)

!["성관계 요구 알려질까"…십년지기 숨지게 한 일가족[그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112900003t.jpg)

