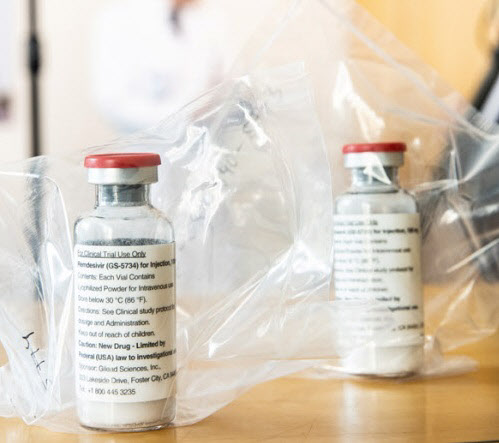
하지만 식품의약품안전처가 미국 제약회사 길리어드 사이언스의 에볼라 신약 후보물질인 ‘렘데시비어’(Remdesivir)를 코로나19 치료제로 특례 수입하기로 결정하면서 렘데시비어 주원료인 ‘뉴클레오시드(Nucleoside)’를 생산하는 파미셀에 있어 호재로 작용할 것이란 관측이다. 현재 파미셀은 글로벌 진단용 및 의약용 뉴클레오시드 시장의 80% 이상을 점유하고 있다.
|
◇ 임상사례 단 2건…치료효과 입증 ‘역부족’
31일 제약·바이오업계에 따르면 지난 3월 30일 파미셀은 코로나19 긴급 치료를 위해 ‘셀그램-AKI’에 대한 ‘치료목적 사용 승인’을 식약처로부터 받았다. 치료목적 사용 승인이란 확실한 치료제가 없는 질환을 앓고 있는 중환자에게 치료기회를 제공하고자 의약품이 품목 허가를 획득하기 전 치료목적으로만 사용할 수 있도록 승인하는 제도를 말한다.
이후 파미셀은 총 3명의 코로나19 확진환자에 대해 셀그램-AKI를 정맥 투여했다. 연세대 원주세브란스기독병원에서 셀그램-AKI를 투약한 환자 2명 가운데 1명이 회복돼 지난 25일 퇴원했고 1명은 사망했다. 가톨릭대 은평성모병원에선 또 다른 1명이 완치되며 그 다음날인 26일 퇴원했다. 첫 번째와 세 번째 환자는 1회 투여만으로 증세가 호전됐다. 그러나 두 번째 환자는 급속도로 폐렴이 악화한 상황에서 치료제를 처방한 경우로 끝내 회복되지 못한 채 패혈증으로 사망했다. 사망률은 세 명 중 한 명이 숨져 단순 계산으론 33.3%에 달한다.
셀그램-AKI 투여환자 세 명은 모두 치료제 투입 직전까지 ‘급성 호흡곤란증후군(Acute Respiratory Distress Syndrome·ARDS)’ 상태로 저산소증이 지속돼 기관 삽관과 기계적 환기를 단행했을 만큼 매우 위중했던 것으로 전해졌다.
|
파미셀 관계자는 “첫 번째·세 번째 환자는 지난달 27일 중합효소 연쇄 반응(PCR) 2회 연속 ‘음성’ 반응을 보였지만 기저질환 때문에 퇴원은 하지 못하고 있었다”면서 “첫 번째 환자는 이달 25일, 세 번째 환자도 26일 각각 퇴원했다”고 확인했다.
완치 환자들이 입원한지 한 달 만에 퇴원한 셈이다. 질병관리본부에 의하면 코로나19 입원 환자의 격리 기간은 평균 23~24일이다. 셀그램-AKI가 코로나19 치료에 대략 효과를 봤다고 볼 수도 있으나 그렇다고 단정하기는 힘들다. 특히 투약 대상이 3명으로 참여자가 적어 임상 데이터가 매우 부족하다. 한 의료계 관계자는 “셀그램-AKI 케이스 두 건으로 코로나19 치료 효능·효과가 있다고 판단할 수 있는 단계조차 해당하지 않는다”고 했다.
파미셀은 충분한 임상 데이터 확보와 관련, “셀그램-AKI를 코로나19 치료제로 개발하기 위한 임상 시험을 진행할 계획이 없다”고 설명했다. 대신 ‘중증 외상으로 인한 ARDS 줄기세포치료제’ 임상을 추진할 예정이다.
|
◇ 넉 달 만에 작년 뉴클레오시드 총매출 돌파
파미셀이 그동안 김현수 대표 주도로 심혈을 기울여온 셀그램-AKI 치료제 개발 의지를 선회한 배경에는 렘데시비어가 작용했다는 분석이 제기된다. 전 세계 중증 코로나19 환자 1000여명 상대로 미국 국립보건원(NIH)이 실시한 위약 대조군 임상 시험에서는 렘데시비어가 코로나19 환자 회복 기간을 15일에서 11일로 31% 단축한 것으로 나타났다. 사망률 또한 렘데시비어 투약군이 약 7%로 위약군 12% 보다 5%포인트 낮았다.
중앙임상위원회는 지난 28일 코로나19 폐렴 치료에 안전성과 유효성이 있다고 평가하며 대체할 항바이러스제가 없는 현실에서 의학적으로 렘데시비어 전격 도입이 필요하다는 데 동의한다는 의견을 제시했다. 오명돈 중앙임상위원장은 “(렘데시비어는) 가장 엄격한 시험을 통과한 최초의 코로나19 표준 치료제로 인정받게 된다”며 “앞으로 개발되는 치료제는 렘데시비어와 견줘 최소한 못하지 않다는 걸 임상 시험에서 증명해야 한다”고 강조했다. 미(美) 식품의약국(FDA)은 이달 초 렘데시비어를 산소 치료가 필요한 중증 이상의 코로나19 환자에게 쓸 수 있도록 긴급사용 승인했다.
|
렘데시비어로 인해 ‘셀그램-AKI’를 약물 재창출하겠다는 뜻을 접지만, 렘데시비어발(發) 실적 개선이 파미셀 반전을 이끌 전망이다. 파미셀은 올 1분기 매출액이 전년 동기 대비 16.3% 늘어난 95억원을 기록했다. 당기순이익 역시 9억원을 시현하며 흑자 기조를 이어갔다. 뉴클레오시드 매출이 지난해 같은 기간에 비해 28% 급증, 32억원을 달성하면서 성장세가 두드러졌다. 파미셀 측은 “뉴클레오시드는 지난 3월부터 본격 출하한 까닭에 해당 매출은 2분기에도 증가 추세를 확대해 나갈 것”이라고 예상했다.
이어 “올해는 바이러스 진단키트·감염병 진단시약 및 유전자 치료제 신약에 관한 주원료로 쓰이는 뉴클레오시드 수주가 코로나19 진단키트 수요 증대와 RNA(리보핵산)를 이용한 유전자 치료제 시장 성장으로 가파르게 확장, 수주량 기준으로 이미 작년 뉴클레오시드의 총 매출 71억원을 넘어선 78억의 매출을 확보한 상태”라고 말했다.
파미셀은 다음 달에만 3건에 이르는 주요 파이프라인 상업화 임상을 추진한다. 셀그램-LC 임상 3상을 신청해 승인 대기 중이며, 셀그램-ED는 임상 2상을 신청해 승인 대기 중이다. 셀그램-DC(전립선암·난소암)의 경우에는 임상 1상을 신청하고 승인을 대기하고 있다.
한편 파미셀은 코로나19 장기적 대처 차원에서 셀그램-AKI 사용이 계속 가능하도록 유지한다는 방침이다. 파미셀은 담당의사 요청 즉시 병원 기관 윤리위원회(IRB)에 승인이 필요한 서류를 발송·지원해 신속하게 치료제가 공급될 수 있도록 한다는 입장이다.

![[단독]SNS 성범죄 증거 삭제 막는다…'불법 영상물 보전명령 도입'](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112900101t.jpg)

!["성관계 요구 알려질까"…십년지기 숨지게 한 일가족[그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112900003t.jpg)

