비아트리스 사업부 인수를 통해 생산을 확대하는 과정에서 기술 부족이 드러났다는 분석이 나온다. 하지만 인도가 전통적인 케미컬 의약품 제네릭(복제약) 강국인 만큼 시행착오가 오래가지는 않을 것이라는 평가도 동시에 나온다.
바이오콘, 인도 생산설비 FDA 기준 충족 못해
17일 업계와 외신을 종합하면 FDA는 바이오콘의 인도 벵갈루루 생산 설비 승인을 최종적으로 거절했다. 해당 공장은 노보 노르디스크의 ‘노보로그’의 바이오시밀러인 ‘아스파트’의 생산을 위한 곳이다.
|
다만 바이오콘은 당장 재승인을 위한 절차는 밟지 않을 계획이다. 키란 마줌다르 쇼(Kiran Mazumdar-Shaw) 바이오콘 회장은 미국 CNBC와의 인터뷰에서 “올해 안에 아스파트를 출시할 계획이 없어, 계획에 큰 차질은 없다”고 답했다.
이승규 한국바이오협회 부회장은 “바이오시밀러와 케미컬 제네릭은 완전히 다르다”며 “인도의 경우 바이오의약품을 생산하기 위한 기술적인 축적이 필요해 보인다. 케미컬은 제조 프로세스를 따르면 되지만, 세포를 가지고 하는 시밀러는 다른 얘기”라고 설명했다.
아일리아 바이오시밀러부터 본격 경쟁
바이오콘은 그간 바이오시밀러 경쟁사로 거론되지 않았던 곳이다. 하지만 지난해 11월 바이오콘 자회사인 바이오콘 바이오로직스가 미국 비아트리스(VTRS)의 바이오시밀러 사업부를 33억달러(약 4조원)에 인수하는 거래를 마무리하면서 삼성과 셀트리온의 경쟁자로 꼽히기 시작했다.
실제로 바이오콘은 비아트리스가 갖고있던 바이오시밀러 10개의 소유권을 확보하게 됐다. 오리지널 의약품 제품명 기준으로 △허셉틴 △뉴라스타 △아바스틴 △란투스 △노보로그 △퍼제타 △란투스 300U △휴미라 △엔브렐 △아일리아 등이다.
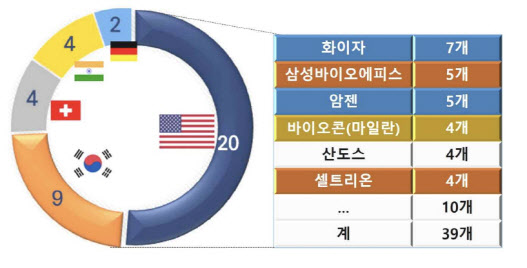
미국 내 승인 받은 바이오시밀러 제품 개수만 해도 화이자(PFE)가 7개로 가장 많고, 삼성바이오에피스와 암젠이 각각 5개로 공동 2등이다. 바이오콘은 셀트리온과 마찬가지로 4개로 선두권이다.
업계에서는 바이오콘의 시행착오가 오래지 않아 끝날 것으로 전망했다. 이 부회장은 “제약 관점에서 본다면 인도가 한국보다 앞선다”며 “인도는 일본의 후지필름과 함께 공격적인 투자를 나서고 있다”고 설명했다.
|
리제네론은 지난 9일 JP모건 바이오 헬스케어 컨퍼런스에서 아일리아 4분기 매출액을 15달러(약 1조8700억원)로 발표했는데, 예상치인 16억5000만달러(약 2조원)보다 낮은 수준이어서 바이오시밀러 경쟁이 벌써 시작됐다는 분석도 나온다. 아일리아의 물질 특허는 미국에서는 오는 5월, 유럽에서는 2025년 5월 각각 만료된다. 삼성바이오에피스는 임상3상을 마친 상태고, 셀트리온은 임상3상을 유럽에서 진행중이다.
한편 바이오시밀러 시장은 지난 2020년 304억달러(약 37조원) 규모로 집계됐다. 프로스트앤설리번에 따르면 매년 연평균 17.4% 성장해 오는 2026년이면 795억달러(약 98조원)에 이를 것으로 분석됐다.




![SK하닉 직원 퇴직금도 대박?…"삼전처럼 성과급 일부 인정 기대"[only 이데일리]](https://image.edaily.co.kr/images/Photo/files/NP/S/2026/02/PS26020900061t.jpg)



