22일 한국거래소에 따르면 셀트리온의 주가는 이달 들어 59.2% 뛰었다. 지난달 말 4만700원에서 6만4800원으로 수직상승하며 시가총액은 6조7000억원을 넘어섰다. 유한양행(1조9238억원), 녹십자(1조7062억원), 한미약품(1조1254억원) 등 국내제약 상위 3개업체의 시가총액 합계보다 2조원 가량 많다.
업계에서는 셀트리온 바이오시밀러의 글로벌 시장 정착에 대한 불확실성이 조금씩 해소되고 있다는 평가다.
이달 초 셀트리온의 유럽, 북미 판매 제휴사인 호스피라가 화이자에 인수되면서 램시마의 글로벌 시장 진출에 청신호가 켜졌다. 램시마는 연 매출 10조원 규모의 ‘레미케이드’를 본따 만든 세계 최초의 바이오시밀러다.
호스피라가 연 매출 50조원을 올리는 화이자의 영업망을 활용하게 되면 ‘램시마’가 당초 예상보다 수월하게 글로벌 시장에 정착할 수 있다는 관측이 제기된다.
여기에 최근 램시마의 미국 진출 가능성도 높아졌다. 셀트리온은 램시마의 미국 허가를 진행하면서 레미케이드와 특허 분쟁도 벌이고 있다. 존슨앤드존슨이 레미케이드의 복제약 발매를 저지하기 위해 특허가 유효하다고 주장하고 있는 상황이다.
하지만 미국 특허상표국이 존슨앤드존슨에 특허 거절을 통보하면서 특허소송에서 유리한 고지에 섰다는 평가를 받는다. 미국 특허상표국의 결정은 향후 법원에서 최종 확정될 예정이다.
신재훈 이트레이드증권 연구원은 “이번 이슈가 램시마의 미국시장 조기 진입여부를 단정 지을 수 있는 사안은 아니지만 미국 내 바이오시밀러 진입장벽은 낮아지고 있다고 판단된다”고 분석했다.
|
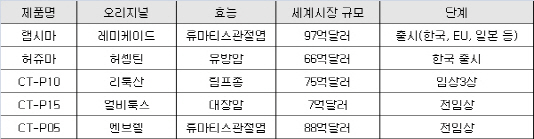
셀트리온의 바이오시밀러 중 글로벌 시장에 가장 근접한 제품은 ‘램시마’다. 램시마는 이미 지난해까지 주요 해외 시장에 대한 진출 채비를 마쳤다. 지난 2012년 국내 발매 이후 지난해까지 유럽, 일본, 캐나다 등에 허가를 마쳤다. 시장 규모가 1조원인 일본에서 지난해 11월 판매를 시작했고 노르웨이에서는 신규환자 우선 처방권을 획득하기도 했다. 레미케이드의 유럽 특허가 이달 중 대부분 만료됨에 따라 램시마는 본격적으로 유럽 판매가 시작될 전망이다.
램시마는 이르면 연내 미국 식품의약품국(FDA) 허가도 통과할 가능성이 높다. 미국은 바이오시밀러의 진입에 대해 가장 보수적인 입장을 견지했지만 지난 2012년 바이오시밀러 허가 규정을 발표했고 지난달 노바티스의 자회사 산도즈가 신청한 1세대 바이오의약품 ‘뉴포젠’의 바이오시밀러 제품의 승인을 정식 권고하면서 바이오시밀러의 진입 장벽을 낮추는 추세다.
셀트리온의 후속 바이오시밀러 제품들도 국내외 시장 진출 채비가 한창이다. 셀트리온은 지난해 1월 ‘허셉틴’의 첫 바이오시밀러 ‘허쥬마’도 배출한데 이어 류마티스관절염치료제 ‘리툭산’의 바이오시밀러 개발을 위한 막바지 임상시험도 진행 중이다.
다만 그동안 글로벌 제약사들의 오리지널 의약품 틈바구니에서 셀트리온의 바이오시밀러 제품이 얼마나 빨리 시장에 정착할지는 낙관할 수만은 없는 상황이다. 해외 의료진이 저렴한 바이오시밀러를 선호할 수도 있지만, 아시아의 신생 업체가 개발한 제품이라는 이유로 처방을 주저할 가능성도 배제할 수 없다.
셀트리온의 재고 부담 해소도 풀어야할 숙제다. 셀트리온 매출의 대부분은 계열사에 셀트리온헬스케어에 바이오시밀러를 공급하면서 발생한다. 셀트리온헬스케어가 셀트리온으로부터 공급받은 제품을 호스피라(서유럽), 이기스(동유럽) 등 글로벌 유통업체들에 판매한다. 이미 셀트리온헬스케어는 수천억원어치 제품을 재고로 보유하고 있어, 유럽 판매가 본격 시작되더라도 셀트리온의 매출이 급증하는 구조는 아닌 셈이다.
셀트리온 관계자는 “지난해까지 램시마의 주요 해외시장 진출 준비를 마쳤다”면서 “올해부터는 본격적으로 바이오시밀러의 해외 매출이 발생하면서 그동안의 연구개발 성과가 가시화할 것으로 기대한다”고 말했다.




![‘세 명' 살리고 하늘로 간 ‘세 아이 엄마'…유족 “보고싶다” [따전소]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24122300722t.jpg)