4일 한올바이오파마에 따르면, 임상 3상 톱라인 결과에서 주요 평가지표의 유의미한 결과를 도출하지 못한 안구건조증 치료 후보물질 HL036은 현재 최종 결과 분석을 진행 중이다. 한올바이오파마는 분석을 토대로 다음 임상시험을 추진할 방침이다.
이번에 시행된 임상 3상에서 한올바이오파마는 주요 평가변수 외 2차 평가변수였던 ‘셔머테스트’에서 유의미한 결과를 확인한 바 있는 만큼 다음 임상 3상은 셔머테스트의 결과에 더 집중할 것으로 예상된다.
셔머테스트는 안구건조증 여부를 확인하기 위해 눈물 분비량을 측정하는 검사다. 일정한 길이의 종이를 아래 눈꺼풀 밑에 걸쳐 놓고 5분간 적셔진 종이 길이를 측정해 안구건조증 개선 여부 등을 판단한다.
한올바이오파마 관계자는 “앞서 진행됐던 임상들 중 셔머테스트 환자반응율 등은 통계적으로 유의한 개선 효과를 보였다”며 “다음에 진행하게 될 임상은 주요 평가지표에 셔머테스트를 넣을 가능성이 높다”고 말했다.
한올바이오파마가 두 번의 임상 3상 실패에도 안구건조증 치료제 개발을 포기하지 않고, 주요 평가변수로 셔머테스트를 설정해 다시 임상에 나서겠다고 밝힌 이유는 FDA가 안구건조증 치료제 개발시 셔머 테스트를 통한 효과 증명도 인정하고 있기 때문이다.
FDA의 ‘안구건조증 신약 개발 가이드라인’에 따르면, 적어도 1개 이상의 객관적 증상 및 주관적인 사전 증상에 대해 시험 대상 물질과 위약 간 통계적 유의성을 입증하는 경우 품목허가가 가능하다고 언급하고 있다.
또는 △통계적으로 유의한 수준의 각막 염색의 완전한 회복이 확인되거나 △셔머테스트에서 10㎜ 증가 또는 그 이상에 도달한 환자 백분율 간 통계적 유의성 등을 입증한 경우에도 품목허가가 가능하다고 명시해놨다.
|
실제로 주요 평가지표를 셔머테스트로 설정한 뒤 그 결과를 바탕으로 FDA 품목허가 받은 안구건조증 치료제는 엘러간 ‘레스타시스’, 오이스터포인트파마 ‘티어바야’ 등이 있다.
먼저 오이스터포인트파마 티어바야의 경우, 투여한 환자 절반 이상인 52%에서 셔머테스트 점수가 착수시점에 비해 10㎜ 이상 증가한 것으로 나타났다. 이어진 임상에서도 ‘티어바야’를 투여한 환자들의 47%에서 이 점수가 10㎜ 이상 증가한 것으로 확인됐다.
또 티어바야를 투여한 환자들은 4주차에 셔머테스트 점수 평균변화도가 11.7㎜로, 위약 대조군 3.2㎜와 큰 차이를 보였다. 아직 승인되지는 않았지만 품목허가 가능성이 높은 알데이라 테라퓨틱스의 안구건조증 후보물질 레플록살랍도 있다.
레플록살랍은 한올바이오파마 HL036처럼 첫 번째 임상 3상에서 주요 평가지표를 달성하지 못했지만, 유의미한 결과를 보인 2차 평가지표 셔머테스트를 주요 평가변수로 바꾸고 한 번 더 임상을 실시해 좋은 결과를 도출했다. 현재는 품목허가 대기 중에 있다.
레플록살랍 임상 결과에 따르면, 레플록살랍을 투여받은 환자 중 16%가 첫날 셔머테스트 점수 10㎜의 개선을 보였다. 대조군에서 10㎜의 개선 비율은 8%로 집계됐다.
◇한올바이오파마 “셔머테스트, P값 충족하면서 유의한 개선”
한올바이오파마의 HL036 역시 셔머테스트에서는 효용성을 나타내고 있다. 한올바이오파마 관계자는 “이번 임상 3상 셔머테스트에서 P값 0.001 미만으로 위약 대비 통계적 유의성을 확보했으며 10㎜ 이상의 개선을 보인 환자반응률도 유의한 차이를 보였다”고 말했다.
두 번째 임상 3상인 VELOS-3 임상 결과에 따르면 2차 평가변수였던 셔머테스트에서 10㎜ 이상의 개선을 보인 환자반응률은 HL036 투여군 15%, 위약군 4%로 집계돼 FDA의 기준을 충족할 것으로 기대된다.
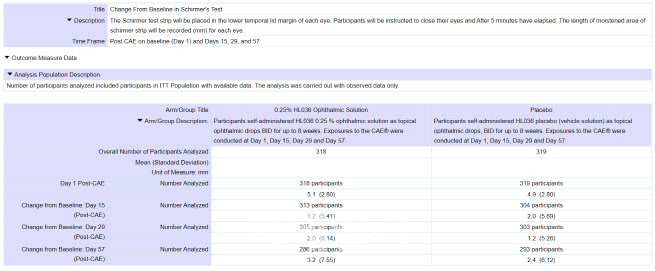
첫 번째 임상 3상 VELOS-2 결과에서도 HL036 투약군 셔머테스트 점수는 1일차 5.1㎜, 15일차 1.2㎜, 29일차 2.0㎜, 57일차 3.2㎜로 나타났다. 이는 위약군 4.9㎜, 2.0㎜, 1.2㎜, 2.4㎜보다 전반적으로 개선된 수치다.
|




!["성관계 요구 알려질까"…십년지기 숨지게 한 일가족[그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112900003t.jpg)
