바이오베터 개발 전문 기업 알테오젠(196170)은 △인간 히알루니다제 기반 제형 변경 플랫폼을 적용한 파트너사의 임상 진전 △개발 막바지에 접어든 2종의 바이오시밀러 △국내 허가 신청한 통증완화제 ‘테르가제’ 등 올해 각종 개발 사업의 성과가 가시화될 전망이다. 회사는 과거 기술수출 건에 대한 추가 마일스톤 수령 및 테르가제 제품 판매를 통한 매출이 발생할 것으로 기대하고 있다.
|
면역항암제 ‘키트루다’ SC 제형 변경 임상 3상 돌입
지난달 14일 미국국립보건원(NIH)의 임상시험 정보사이트 ‘클리니컬 트라이얼’에 따르면, 미국 머크(MSD)의 면역항암제 ‘키트루다’(프로젝트명 MK-3475)의 피하주사(SC) 제형의 임상 3상 계획이 등록됐다.
알테오젠이 직접적으로 언급하진 았았지만, 시장에서는 키트루다의 SC 제형 변경 임상이 알테오젠의 인간 히알루로니다제 제형 변경 플랫폼 ‘ALT-B4’을 통해 진행되는 것으로 알려져 있다.
정자의 머리 부분에 존재하는 단백질 PH20는 수정 시 난자의 막을 뚫는데 사용되는 물질이다. 이를 피부에 주사하면 피하 지역에 있는 당사슬을 잘게 부숴 약물이 통과시킬 수 있다. 정맥주사로 개발된 항체치료제와 PH20을 섞으면 피하주사로 제형을 바꿀 수 있는 셈이다.
ALT-B4는 몸속에 떠다니는 히알 단백질과 PH20의 도메인(단백질 내 특정 구역을 의미) 일부를 조합해 개발됐다. 세계적으로 미국 할로자임과 알테오젠 등 단 두 기업만이 히알 단백질을 활용한 제형 변경 기술을 보유한 상황이다.
지난 2020년 알테오젠은 최대 38억6500만 달러 (당시 약 4조7000억원) 규모로 글로벌 제약사(빅파마)와 ALT-B4의 기술수출 계약을 맺었다. 비슷한 시기 머크가 자사 키트루다의 SC 제형 변경을 위한 임상을 시작했다. 이때문에 경쟁사인 암젠 등이 할로자임과 계약을 체결한 것을 고려할때, 키트루다 SC 제형 변경 임상에 적용된 기술이 알테오젠의 것이란 분석이 힘을 받았다.
알테오젠 관계자는 “우리 ALT-B4을 가져간 파트너사를 언급할 순 없지만, 최근 해당 기업이 시도하는 제형 변경 임상이 3상에 돌입한 것은 맞다”며 “이같은 파트너사의 임상 개발 단계 진전으로 상반기 중 추가 마일스톤을 받게 됐다. 다만 그 금액은 비공개 사항이다”고 말했다.
|
허셉틴·아일리아 바이오시밀러 글로벌 개발 순항
알테오젠은 2010년대 초중반부터 스위스 로슈의 유방암 치료제 ‘허셉틴’(성분명 트라스트주맙)과 미국 리제네론 파마슈티컬스의 황반변성 치료제 ‘아일리아’(성분명 애플리버셉트) 등 2종의 항체치료제에 대한 바이오시밀러 개발을 시도했다.
이중 알테오젠이 개발하던 허셉틴 바이오시밀러 ‘ALT-L2’는 2017년 중국 치루제약(QILU Pharmaceutical)에 기술수출됐다. 알테오젠은 해당 물질의 국내 개발 과정을 임상 2상 단계에서 중단했다. 회사 측은 이미 너무 많은 허셉틴 바이오시밀러가 시장에 출시되면서, 개발 중인 ALT-L2로 충분한 시장점유율을 확보할 수 없다고 판단했다.
반면 칠루제약은 ALT-L2의 개발을 지속했고, 지난해 11월 임상 3상을 완료했다. 알테오젠 관계자는 “시밀러는 1~3순위 내로 등장해야 시장 점유율 선점에 유리하다”며 “우리가 파악하기로 세계 주요국에서는 허셉틴 바이오시밀러를 넘어 SC제형까지 나왔다. 하지만 중국의 상황은 다르다”고 운을 뗐다.
알테오젠에 따르면 현재 중국 3S바이오의 ‘CIPTERBIN’과 헨리우스바이오텍의 ‘ZERCEPAC’ 등 총 2종의 허셉틴 바이오시밀러가 중국에서 승인됐으며 모두 정맥주사로 개발된 오리지날이다. 앞선 관계자는 “치루제약이 아직은 허가 신청을 하진 않았다. 이를 상반기 중 진행할 것으로 알고 있다”며 “ALT-L2가 중국에서 허가되면 총 3종의 시밀러가 경쟁을 펼쳐 승산이 있다”고 말했다.
이밖에도 지난달 22일 알테오젠 자회사 알토스바이오로직스가 12개국에서 431명을 대상으로 글로벌 임상 3상 중인 아일리아 바이오시밀러 ‘ALT-L9’의 환자모집을 완료했다고 밝혔다. 회사 측은 아시아 지역에서 특허가 만료되는 2025년 ALT-L9를 출시하는 것을 목표로 하고 있다.
아일리아는 2021년 세계에서 92억 달러(약 10조원) 매출을 올린 블록버스터다. 미국이나 유럽 등 주요국 내 아일리아 물질특허는 2027~2030년 사이에, 중국이나 한국, 일본 등 아시아 국가에서는 2024년에 만료된다.
|
통증완화용 ‘테르가제’ 국내 출시 예정...“해외 진출 가능성도”
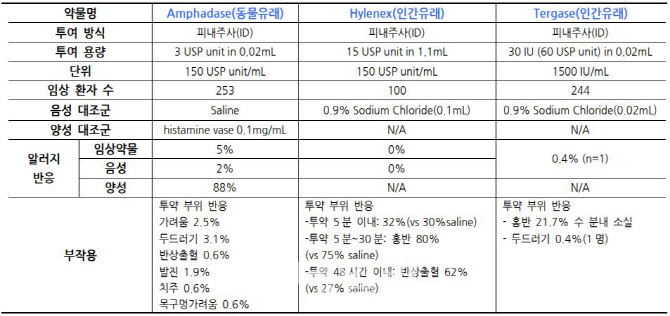
알테오젠은 지난달 인간 히알루로니다제를 통증 및 부종완화제로 개발한 ‘테르가제’(프로젝트명 ALT-BB4)의 국내 품목허가를 신청했다. 회사 측은 올해 중 테르가제의 출시가 가능할 것으로 전망하고 있다.
국내 통증완화제 시장은 약 500억원, 세계적으로는 1조원 가량의 통증완화제 시장이 형성돼 있다. 해당 시장에서는 스테로이드와 같은 소염진통제나 동물에서 얻은 히알루로니다제 등이 널리 쓰여왔다. 현재 국내외에서 출시된 제품 중 할로자임의 ‘하일레넥스’가 유일한 인간 히알루로니다제 기반 물질이다. 국내에서는 하일레넥스를 비롯해 조아제약(034940)의 피시엘디 등 16여 종의 동물 히알루로니다제들이 유통되고 있다.
알테오젠은 비교적 부작용이 큰 동물 히알루로니다제 시장을 테르가제가 빠르게 대체할 수 있을 것으로 분석하고 있다. 관련 임상에서 인간 히알루로니다제로 만든 할로자임의 하이일넥스와 비교해도 테르가제의 순도가 높고 부작용도 적은 것으로 확인된 바 있다.
회사 관계자는 “테르가제가 동물 히알루로니다제보다 비교우위에 있다고 판단하지만, 편하게 쓸 수 있는 통증완화제 종류가 너무 많다”며 “국내 시장에 출시한 뒤 테르가제의 시장성을 더 명확하게 뜯어볼 것이다. 그런 다음 충분한 수익이 기대된다고 판단되면 해외 시장 진출도 시도할 수 있다”고 말했다.


!["퍼스널컬러가 국방색이라고?" 우즈의 새로운 '남친룩'[누구템]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26021400146t.jpg)
![다 큰 어른들이 술래잡기를?…폰 놓고 뛰노는 청년들[르포]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26021400401t.jpg)
![야산서 발견된 백골 소년…범인은 동료 ‘가출팸'이었다 [그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26021400001t.jpg)
![“자리가 없다” 교도소 '비명'…1월에만 1428명 '사회로'[only 이데일리]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26021400392t.jpg)