사람의 경우는 어떨까요. 사람도 손톱은 매달 3.5㎜, 머리카락은 매일 0.5㎜ 자랍니다. 피부도 어느 정도 상처가 생기면 새살이 돋아나 아물기도 합니다. 사람의 간도 재생능력을 갖고 있습니다. 간 절제 수술로 70% 정도를 없애도 약 2달 후에는 다시 원래 크기까지 자라기도 합니다. 그러나 사람의 재생능력은 도마뱀·해삼 등과 달리 어느 정도 한계가 있습니다. 이러한 한계를 극복, 손상된 인체 세포와 조직, 장기를 대체하거나 다시 생기도록 만드는 의료기술이 바로 ‘재생의료’입니다.
재생의료는 인체의 세포와 조직, 장기를 대체하거나 복원하는 것뿐만 아니라, 사람 몸이 스스로 재생할 수 있도록 돕는 기술을 모두 의미합니다. 초기 재생의료는 주로 새로운 치료용 세포와 조직을 만드는 기술을 의미했습니다. 그러나 다양한 기술을 시도하고 발전하면서 현재는 약물과 바이오 소재, 의료기기 등을 이용해 손상된 인체 부위 재생을 돕는 기술까지 모두 재생의료로 봅니다.
◇살아있는 ‘세포’로 손상된 기능 복구하는 ‘재생의료’
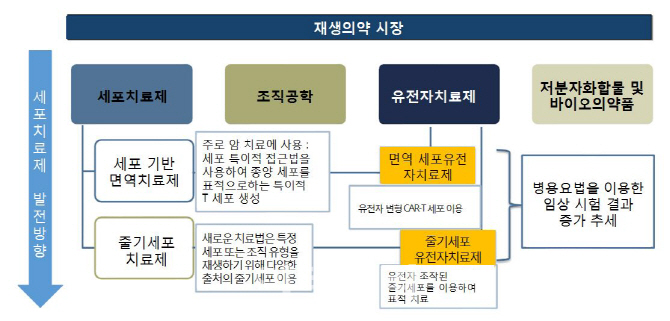
재생의료는 기존 의료기술 개념을 바꾸고 있습니다. 기존 수술·약물치료는 증상을 완화하거나 진행을 억제하는 것을 주 목적으로 합니다. 하지만 손상된 인체 구조 및 기능을 원래 형태로 복원하는 것은 불가능합니다. 반면 재생의료는 손상된 조직과 기능을 원래 상태로 복구하는 효과를 기본적인 치료 개념으로 보고 있습니다. 이 같은 재생의료의 핵심은 살아있는 ‘세포’입니다. 모든 생명체는 세포로 구성됩니다. 사람의 경우 약 37조개의 세포로 이뤄졌습니다. 사람과 동물 등의 세포를 의약품처럼 치료제로 사용, 세포를 교체하거나 재생하는 것을 ‘세포치료제’라고 합니다.
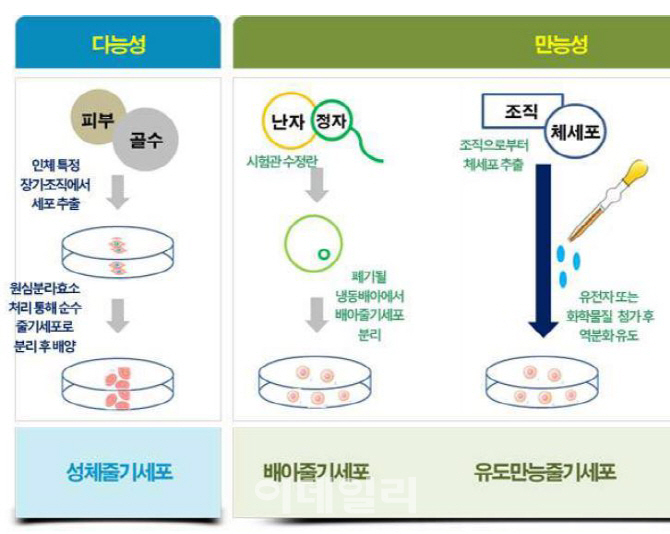
세포가 어떤 역할을 수행하기 위해 분열과 증식을 반복하면서 고유의 구조와 기능을 갖는 것을 ‘분화’라고 합니다. 이미 분화해 일자리가 정해진 세포는 체세포이며, 이를 활용해 만든 약이 ‘체세포 치료제’입니다. 피부·연골 등 조직에 맞는 체세포를 넣어 조직을 재생하도록 만드는 것입니다. ‘줄기세포’는 아직 일자리가 정해지지 않은 ‘미분화’ 상태의 것을 의미합니다. 정자와 난자가 만나 수정된 지 14일이 안된 배아상태에 있는 세포는 ‘배아줄기세포’라고 하며, 인체 모든 조직으로 분화할 수 있는 잠재력이 있지만 이를 연구하는 것에는 윤리적인 논란이 있습니다.
이미 성숙한 체세포를 인위적으로 조작해 다시 미숙한 줄기세포로 만드는 기술도 있습니다. 체세포 시계를 거꾸로 돌려 다시 배아줄기세포 특성을 갖도록 만드는 ‘유도만능줄기세포’입니다. 유도만능줄기세포는 일본 야마나카 신야 교토대 교수가 2006년 생쥐 피부세포를 연구하다가 발견한 것으로, 배아를 파괴하지 않고 얻을 수 있어 윤리적인 문제에서 자유로운 것이 특징입니다. 야마나카 신야 교수는 이에 대한 공로로 2012년 노벨 생리의학상을 받았습니다.
치료제 개발이 가장 활발한 분야는 ‘성체줄기세포’입니다. 분화의 방향이 거의 정해져 있고 분화능력은 낮지만 비교적 안전한 세포로 알려졌기 때문입니다. 성체줄기세포는 사람 몸의 장기와 기관에 존재하면서 신체가 손상됐을 때 재생작용을 하는 줄기세포입니다. 골수와 탯줄(제대혈) 등에 있는 조혈줄기세포와 중간엽줄기세포 등이 대표적입니다. 성체줄기세포 치료제로는 △자신의 건강한 연골을 분리·배양한 후 손상된 연골부위에 이식해 연골 재생을 유도하는 ‘연골 줄기세포치료제’ △여러가지 난치성 질환 치료에 대비해 제대혈을 분리·보관했다가 백혈병·혈액질환·선천성 면역질환 등이 생기면 치료에 사용하는 ‘제대혈 줄기세포치료제’ △자신의 건강한 뼈세포를 분리·배양한 후 뼈가 손상되면 이를 이식해 재생을 유도하는 ‘뼈 줄기세포치료제’ △순수지방세포를 분리해 주름·가슴성형 등에 주입하는 ‘지방 줄기세포치료제’ 등이 있습니다.
또 치료 방법에 따라 △환자 자신의 줄기세포를 활용하는 것은 ‘자가줄기세포치료제’ △다른 사람의 줄기세포를 활용하는 것은 ‘동종유래줄기세포치료제’ 등으로 구분하기도 합니다. 동종유래줄기세포치료제의 경우 원래 자신의 몸에 있던 것을 이식하는 것이 아니기 때문에 면역거부반응 등의 문제점이 생길 수 있습니다. 다른 사람의 줄기세포를 이용하는 것이 아니라 동물의 줄기세포를 이용하는 ‘이종줄기세포치료제’도 윤리성에 대한 논란이 제기됩니다.
줄기세포치료제 외에 유전자치료제도 재생의료 범위에 포함됩니다. 부족하거나 돌연변이를 갖고 있는 유전자를 몸 밖에서 공급해 본래 기능을 복원하기 때문입니다. 유전자치료제는 △환자 몸에서 유전자를 전달하고자 하는 세포를 채취해 이 세포에 치료 유전자를 전달한 후 다시 환자 몸 속으로 넣는 ‘생체 외’(Ex vivo) 방식 △치료 유전자를 포함한 유전자 전달체를 환자 몸에 직접 주입해 알아서 타깃 세포를 찾아 들어가도록 하는 ‘생체 내’(In vivo) 방식이 있습니다. 건강한 사람 또는 암 환자 혈액에서 면역세포 일종인 ‘T세포’를 추출·분리, 암세포를 잘 찾아 파괴할 수 있는 유전자를 주입·증폭해 다시 투여하는 ‘키메릭 항원 수용체 발현 T세포’(CAR-T) 치료제도 유전자치료제 기술 중 하나입니다.
체내 장기와 기관 등을 자동차 부품 갈아 끼우듯 바꿀 수 있는 ‘조직공학’ 분야도 재생의료로 분류합니다. 인공피부와 인공뼈, 연골조직, 인공혈관 등이 주요 사례입니다. 특히 3차원(3D)프린터로 원하는 인체 장기를 찍어내 실제 기능을 하도록 만드는 인공장기 분야에서 최근 연구가 활발히 이뤄지고 있습니다. 이 같은 3D 바이오프린팅 기술은 보형물과 뼈를 만드는 것에서 나아가 인공 각막을 만들고, 임상시험에 활용할 수 있도록 몸 속 장기와 비슷한 장기유사체인 ‘오가노이드’를 제작하는 등 혁신을 거듭하고 있습니다.
◇위험성 동반한 혁신…세계 시장은 성장
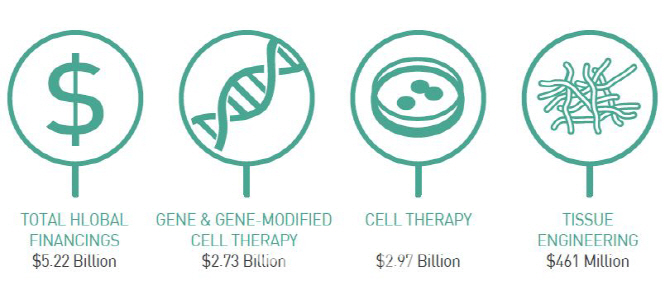
이처럼 재생의료가 인류 건강 관리 패러다임을 바꿀 것으로 기대를 모으고 있습니다. 하지만 위험성도 큽니다. 배아연구와 이종이식 등에 대한 윤리 문제와 세포 주입 과정에서의 감염 등 안전성 문제가 뒤따르기 때문입니다. 미국 재생의료협의회(ARM)에 따르면 지난 2016년 재생의료 분야 전체 투자액은 전년대비 51.7% 감소한 52억 2000만달러에 그쳤습니다. 2015년 재생의료 분야 총 투자 규모가 전년대비 106% 증가한 108억달러에 달했던 것과 대조적입니다.
세포치료제 분야는 29억 7000만달러로 전년대비 57.6% 줄었고, 유전자치료제 분야는 27억 3000만달러로 전년보다 59.9% 감소했습니다. 조직공학분야도 4억 6000만달러로 전년대비 42.9% 줄었습니다. 이는 유전자 치료제 분야 대표주자였던 미국 주노테라퓨틱스가 2016년 상반기 진행한 항암치료 임상에서 5명의 사망자가 발생, 안전성 문제가 부각된 이유가 컸습니다. 그러나 지난해 미국 식품의약국(FDA)이 꿈의 항암제라 불리는 ‘CAR-T’ 유전자 치료제 노바티스의 ‘킴리아’를 처음으로 허가하면서 안전성 문제에 대한 불안감은 일부 해소되는 분위기입니다. 재생의료 분야에서 인수·합병(M&A)도 활발한 추세입니다. 이와 관련 미국 셀진이 올해 1월 주노테라퓨틱스를 90억달러에 사들이기도 했습니다. 암을 정복하는 유전자 치료제가 향후 성장을 견인할 미래먹거리가 될 것이라고 내다봤기 때문입니다.
재생의료 시장은 앞으로도 지속적으로 성장할 전망입니다. 보건복지부에 따르면 지난 2014년 45억달러였던 세계 재생의료 시장 규모는 연평균 17.3% 성장률을 보이며 오는 2026년 308억 6200만달러까지 커질 것으로 예상됩니다.
|
|
|








![결혼 앞둔 예비신부 사망…성폭행 뒤 살해한 그놈 정체는 [그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/03/PS26031200001t.jpg)