|
제약·바이오 시장을 이끌 ‘신흥 바이오벤처’(Emerging BioPhama)의 요람으로 미국에 이어 중국이 급부상하고 있는 것이다. 최근 아이큐비아가 발표한 ‘2021년 글로벌 R&D 트랜드 보고서’에 따르면 세계 신흥 바이오벤처는 2021년 기준 4700여 개의 신약 후보를 개발하는 중이다. 미국 기업이 약 46%의 비중을 차지하고 있다. 하지만 보고서는 바이오벤처 산업의 탄생 초기였던 2006년경부터 50% 이상을 유지하던 미국의 비중이 점차 하락세에 접어든 것으로 분석했다. 반면 중국 신흥 바이오벤처의 산업 비중은 2016년까지 줄곧 6% 안팎에 머물렀지만, 2021년 그 비중이 17%로 크게 올랐다. 이런 중국의 성장세를 가장 뚜렷하게 보여주는 사례가 앞서 언급한 헨리우스와 레전드다.
中헨리우스, 거대 내수시장 잡고 세계로
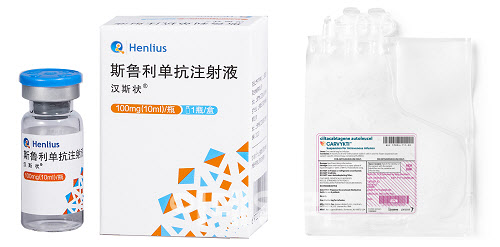
헨리우스는 중국의 대표적인 항체 바이오시밀러 기업으로 출발한 바이오텍이다. 회사는 스위스 로슈의 유방암 치료제 ‘허셉틴’(성분명 트라스트주맙) 및 류마티스 관절염 치료제 ‘리툭산’(성분명 리툭시맙), 미국 애브비의 ‘휴미라’(성분명 아달리무맙) 등 각종 항체치료제의 바이오시밀러를 개발해 각국에서 출시하고 있다. 헨리우스의 지난해 매출은 32억1470만 위안(한화 약 6140억원)으로 전년 대비 91%가량 큰 폭으로 성장했다.
지난달 26일 헨리우스는 자사의 PD-1 계열의 면역항암제 후보 ‘한시주앙’(Hansizhuang, 성분명 세르풀리맙)과 화학항암제 병용요법을 성인 확장기 소세포폐암의 1차 치료제로 승인받기 위한 허가 신청서가 유럽의약품청(EMA)으로부터 수락됐다고 밝혔다. 헨리우스에 따르면 한시주앙은 지난해 1월 중국에서 소세포폐암 치료제로 승인받은 다음, 같은 해 비소세포폐암 등 2종 적응증을 확대하는데도 성공했다. 지난해 3월 중국에서 출시된 한시주앙은 이미 1만3000명에게 처방된 것으로 확인됐다.
항체 신약 개발 업계 한 관계자는 “중국 내부의 대량 수요가 있어 헨리우스는 중국에서 이에 충당하는 약물을 생산해 규모의 경제를 비교적 쉽게 가져갈 수 있었다”고 운을 뗐다. 이어 “국내 바이오시밀러 기업이 진입 장벽이 높은 유럽이나 미국시장에 진출해야 의미있는 규모의 매출을 올리는 것과 다른 상황이다”며 “중국 정부의 지원에 힘입어 신규 적응증 허가도 빠르게 나오면서 바이오텍이 신약개발을 위한 자금력을 빠르게 모을 수 있었을 것”이라고 설명했다. 이번에 주요국인 유럽에서 한즈시앙이 승인될 경우 헨리우스는 국내 대표 K-바이오 기업 셀트리온(068270) 보다 한발 앞서 바이오시밀러 전문 회사에서 글로벌 신약개발사로 변신하는 데 성공하는 모양새다.
한편 헨리우스는 지난 2015년 앱클론(174900)의 HER2 양성 전이성 위암 대상 항체 신약 후보 ‘AC101’(중국 코드명 HLX22)를 총 5650만 달러 규모로 기술이전받았다. 회사는 지난해 9월 해당 약물의 객관적 반응률(ORR)이 85% 이상이라는 중국 내 임상 2상의 중간 예측결과를 발표했다.
앱클론 관계자는 “전임상 단계에서 기술수출했던 AC101의 중국 내 임상이 차질없이 진전돼 왔다. 2019년에 시작된 임상 2상이 내년 하반기에 끝난다”며 “상반기 중에는 지난해 발표한 예측치가 아닌 실질적인 AC101의 임상 2상 중간 결과가 도출될 것으로 파악하고 있다”고 말했다.
|
첨단 신약 임상 주저할 때...中선제적 진입 허가
세포유전자치료제와같은 첨단 신약에 대한 전향적인 개발 지원 조치 또한 중국 바이오텍 성장의 원동력이다.
헨리우스 만큼 주목받는 바이오텍 레전드는 2017년 자국 내 19명의 다발성 골수종 환자를 대상으로 CAR-T 신약 ‘카빅티’(성분명 실타캅타젠 오토류셀)의 임상 1상 결과를 발표했다. 이를 확인한 미국 얀센이 레전드에게 400억원을 주고 카빅티의 공동개발권을 기술이전받았다. 양사는 결국 지난해 2월 미국식품의약국(FDA)으로부터 최초로 다발성 골수종을 적응증으로 하는 카빅티의 품목허가를 획득했다.
첨단 신약 개발 업계 또다른 관계자는 “중국 규제 당국이 카빅티의 임상 1상을 선제적으로 승인해주면서 2017년 초기 결과를 낼 수 있었던 것”이라며 “유전자나 이중항체 등 첨단 신약 기술력에서 국내 바이오벤처의 기술력도 중국에 뒤지지 않는 세계적인 수준이지만, 초기 임상 진입이 비교적 늦었고 개발 성공 사례 역시 아직 없다”고 말했다.
실제로 한국보건산업진흥원이 지난 3월 내놓은 ‘2022년 보건의료산업 기술수준평가’보고서에 따르면 최고 기술 보유국인 미국을 100으로 볼 때, 유럽(88.4%) 일본(81.7%), 한국(79.4%), 중국(74%) 순으로 나타났다. 이를 바탕으로 환산한 미국과 한국의 기술격차는 2.5년으로 중국(3.2년) 보다 적게 나온 것이다.
앞선 관계자는 “중국이든 우리든 바이오텍의 기술 경쟁력은 세부 분야에서 차이가 있겠지만, 각종 첨단 신약 후보물질 발굴 능력을 모두 가지고 있다”며 “첨단 세포 신약의 경우 자국 내에서 소수 인원으로 임상을 해도 글로벌 임상 데이터로 쓸 수 있는 사례들이 나와 있다”고 설명했다. 이어 “국내 신흥 바이오텍의 임상 진입을 위한 안전성 데이터 등을 빠르게 도출할 수 있도록 비임상, GLP임상 단계의 세부적이고 체계적인 지원이 필요하다”고 말했다.









![결혼 앞둔 예비신부 사망…성폭행 뒤 살해한 그놈 정체는 [그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/03/PS26031200001t.jpg)