|
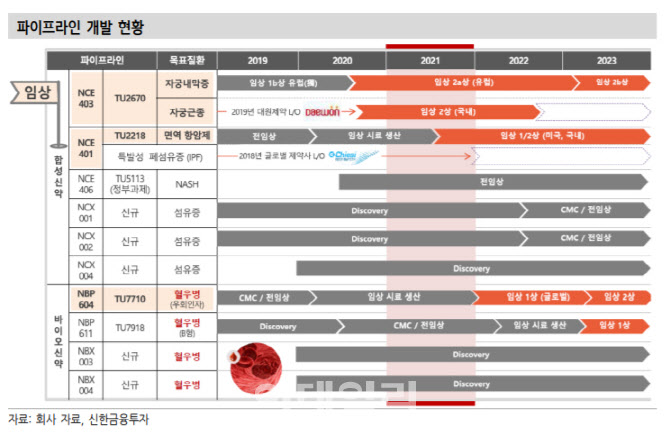
티움바이오는 지난 8월 미국 식품의약국(FDA)에 임상계획서(IND) 승인을 획득했고, 국내 식약처에는 10월 IND를 제출했다. 올해 4분기 중 첫 환자 투여가 예상된다.
장세훈 연구원은 “임상은 단독요법과 면역항암제 병용요법으로 진행된다”며 “병용요법은 2022년 3분기 개시가 예상되며, 스폰서 임상 진행이 기대된다”고 분석했다.
장 연구원은 “스폰서 후보군은 다양하며, 전임상 결과를 바탕으로 몇몇 제약사와 논의 중인 것으로 파악된다”며 “스폰서 임상 계약 체결 시점은 병용요법이 시작되는 임상 1b상 개시 전으로 예상된다”고 전했다.
티움바이오의 자궁내막증 치료제 TU2670은 유럽 임상 2a상을 진행 중이다. 올해 8월에 임상이 개시됐으며, 10월 초 기준으로 18명의 환자 모집이 완료됐다. 임상은 총 80명 환자를 대상으로 진행한다.
장 연구원은 “5개국 40여개 기관에서 진행한다는 점을 고려하면 향후 빠른 환자 모집 완료가 기대된다”며 “임상 2a상 종료 시점은 2023년 1분기로 예상된다”고 말했다.
그는 “혈우병치료제 TU7710은 임상의약품 생산 마무리 단계에 있는 것으로 파악된다”며 “글로벌 임상 1상으로 계획 중이며, 연내 IND 제출 후 내년 초에 임상 개시가 전망된다”고 판단했다.
한편 지난 7월 티움바이오는 3자배정 유상증자 형태로 SK플라즈마에 300억원 규모의 투자를 진행했다. SK디스커버리 500억, 한국투자파트너스 300억까지 총 1100억원 규모의 투자다.
장 연구원은 “SK플라즈마는 투자 자금을 바탕으로 NRDO(개발 중심 바이오벤처) 신사업과 혈액제제사업 확장을 진행할 계획이다”며 “이번 투자 건으로 양사간의 지속적인 시너지가 기대된다”고 강조했다.
그는 “티움바이오는 SK플라즈마에 파이프라인 공급이 가능하며, NRDO 신사업 진행에 기여할 것으로 생각된다”며 “향후 SK플라즈마 상장시 자본적인 이득도 기대된다”고 덧붙였다.
티움바이오는 또 위탁개발생산(CDO) 전문 자회사 프로티움사이언스 설립을 통한 신성장 동력도 확보했다. 장 연구원은 “단백질 분석 서비스를 시작으로 장비 세팅이 완료되는 연말부터 본격적인 CDO 매출이 기대된다”며 “장기적으로는 CDO 트랙레코드를 확보해 위탁생산(CMO) 기업과 협업을 사업모델로 계획하고 있다”고 전했다.

![악몽의 크리스마스…32명 사상자 낸 도봉구 아파트 화재[그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24122500032t.jpg)


