|
CSR 공시 대상에 추가, 통계값 기재 강조
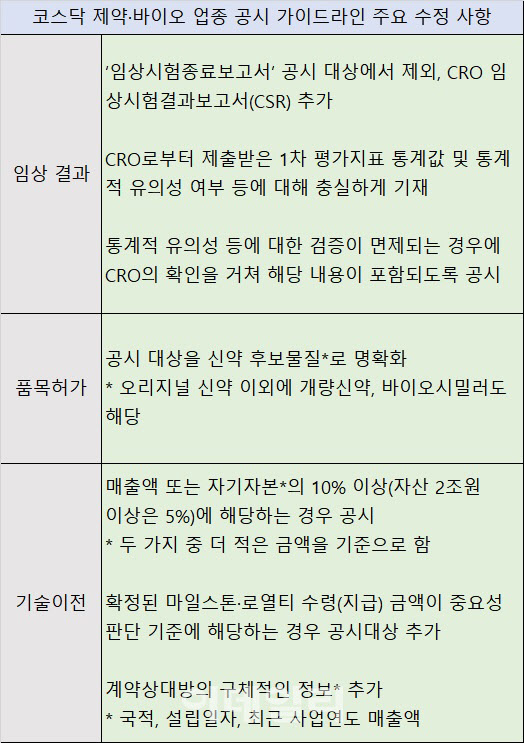
가이드라인 수정본의 가장 큰 변화는 임상 시험 결과에 대한 공시다. 다음 달부터는 임상시험종료보고서가 공시 대상에서 제외되는 대신 CSR(임상시험결과보고서)이 포함됐다. CRO로부터 탑라인 데이터 또는 CSR을 받으면 공시 대상이다. 특히 통계값 기재에 대해 강조하는 내용이 추가됐다. CRO로부터 제출받은 1차평가지표 통계값 및 통계적 유의성 여부 등에 대해 충실하게 기재해야 한다. 임상 디자인에서 통계적 유의성에 대한 검증이 면제되는 경우 공신력 있는 CRO의 확인을 받았다는 내용까지 포함해 공시해야 한다.
통계값은 P값이며, 통계적 유의성 충족 여부를 나타낸다. 통상적으로 1차평가지표 P값이 0.05 이상 나왔을 경우 해당 임상은 실패(Fail)라고 하고, 0.05 이하는 성공(Pass)적인 임상이라고 표현한다. 1차평가지표(Primary endpoint) 확보는 성공적인 임상 시험을 입증하는 선결조건이다.
다만 임상 결과 공시에서 환자수가 빠진 점에 대한 지적이 나온다. 거래소는 임상시험 진행 공시와 임상시험 결과 공시를 나눠서 모범안을 제시하고 있다. 임상시험 진행 공시에는 ‘임상시험 대상 환자의 규모’가 포함돼 있지만, 임상 결과 공시에는 빠져 있다.
바이오회사 임원은 “통계값은 달성했는데 원래 모집하려던 규모보다 훨씬 적은 환자수 5명밖에 없으면 의미가 없다”며 “반대로 통계값은 달성 못했지만 대규모로 환자가 참여하면, 추가적으로 지켜볼 필요가 있다는 결과로 해석할 수도 있다”고 말했다. 이어 “미국은 회사에서 기업설명회(IR)를 열고 참여환자수, 그 중에 탈락한 환자수, 최종적으로 결과에 들어간 환자수 전부 공개한다. 워낙 일반적인 상식이라서 바이오 가이드라인조차 없다”며 “한국은 바이오 시장이 미성숙하기 때문에 임상 결과로 장난치는 곳이 많다. 투자자들을 위해서 금융 당국의 가이드라인이 제대로 작용해야 한다”고 덧붙였다.
|
품목허가 의약품 기준 및 기술이전 금액 명확화
거래소는 품목허가의 범위와 기술이전 공시에 대해서도 명확히 했다. 기존 가이드라인은 품목허가 공시의 중요성에 대한 설명만 있고, 공시 대상인 의약품 기준에 대해서는 불명확했다. 하지만 수정된 가이드라인에는 품목허가에 관한 공시 대상을 신약 후보물질, 오리지널 신약 이외에 개량신약, 바이오시밀러도 해당된다고 명시했다.
기술이전은 계약금액이 ‘자기자본’의 10% 이상에서 ‘매출액 또는 자기자본’의 10% 이상으로 변경됐다. 단 자산 2조원 이상은 5%다. 매출과 자기자본 중 보수적으로 작은 금액을 기준으로 판단한다. 확정된 마일스톤·로열티 수령(지급) 금액이 해당 기준에 해당하는 경우에도 공시 대상이다. 또한 국적, 설립일자, 최근 사업연도 매출액 등 계약상대방의 구체적인 정보도 공시에 포함해야 한다.






![독극물 처리? 그냥 싱크대에 버려 [그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26020900001t.jpg)


!['120억' 장윤정·도경완의 펜트하우스, 뭐가 다를까?[누구집]](https://image.edaily.co.kr/images/Photo/files/NP/S/2026/02/PS26020800099t.jpg)