6일 제약·바이오 업계에 따르면 미국 머크 외에도 10여곳의 국내·외 개발사들이 먹는 치료제를 개발하고 있다. 아직까지 미국 당국의 승인을 받은 먹는 치료제는 없다. 국내에서도 개발된 코로나19 치료제는 셀트리온(068270)의 렉키로나가 있지만 정맥 주사제로 개발됐다.
긴급 승인 신청을 앞둔 미국 머크를 바짝 쫓는 곳은 이스라엘 레드힐(RedHill)과 일본의 시오노기(SHIONOGI)다.
|
시오노기도 지난달 27일 경구용 코로나19 치료제 2/3상이 돌입한다고 밝혔다. 지난 7월에 임상 1상을 시작했는데, 긍정적인 결과가 나왔다는게 회사 측 설명이다. 2/3상에서는 경증이나 무증상 환자를 대상으로 1일 1회 5일동안 경구 투약시 위약 대비 유효성과 안전성을 평가할 예정이다. 2/3상 진입 속도는 빠르지 않았지만 상품화 시점은 당장 내년 초로 잡혀있다. 시오노기는 내년 3월말에는 100만명분의 생산설비를 갖추고 실제 공급을 시작하는 것을 목표로 세웠다.
메신저리보핵산(mRNA) 백신 개발로 전 세계적으로 기술력을 입증한 화이자(Pfizer)의 경우에도 시오노기와 비슷한 시점에서 임상2상을 시작한다고 밝혔다. 스위스 로슈(Roche)와 미국 바이오 벤처 아테아(Atea)도 최종 단계인 임상3상을 진행중이다. 로슈는 신종플루 치료제인 ‘타미플루’ 개발사다. 아테아는 국내 벤처캐피탈(VC)인 아주IB투자(027360)의 투자 포트폴리오사로 국내에 잘 알려져있다.
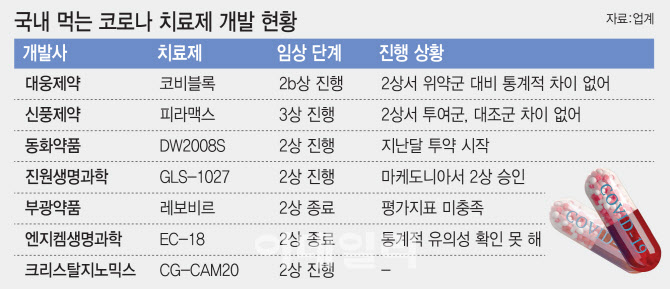
국내 제약·바이오 업체들도 경구용 코로나19 치료제를 개발하고 있다. 다만 2상까지 결과를 봤을때 긍정적인 성적표를 받아든 곳은 없다.
대웅제약(069620)은 만성 췌장염 치료제 ‘코비블록’을, 신풍제약은 말라리아 치료제 ‘피라맥스’를 각각 경구용 치료제로 개발하고 있다. 하지만 이들 모두 임상 2상 결과 유효성을 입증하지 못했다는 지적을 받고 있다.
대웅제약은 이달 추가 임상인 2b상 추가 분석 결과를 내놓을 예정이다. 대웅제약은 이번 분석 결과에 따라 임상3상 진입 여부를 결정한다는 입장이다. 신풍제약은 임상3상을 진행중이다.
이들과 다른 선택을 한 곳도 있다. 부광약품(003000)은 간염 치료제 ‘레보비르’를 치료제로 개발하려 했으나, 임상3상을 진행하지 않기로 했다. 임상2상에서 통계적으로 유의미한 결과를 확보하지 못해서다.
글로벌 선진국 제약·바이오사에 비해서는 속도 측면에서 뒤처지는 상황이다. 국내 업계 관계자는 “국내 경구용 치료제는 연내에 성과를 내기 어려운 상황”이라고 말했다. 임상 결과가 좋아 회사측의 계획대로 진행돼 긴급사용승인을 노려본다 하더라도 빨라야 내년이라는게 업계의 공통된 분석이다.