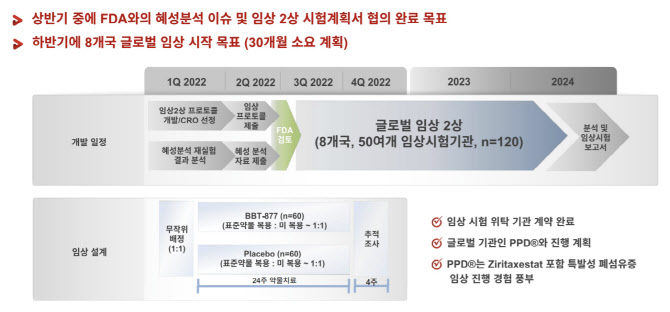
4일 브릿지바이오테라퓨틱스(이하 브릿지바이오)에 따르면 2분기 중 특발성 폐섬유증(IPF) 치료제 후보물질 ‘BBT-877’에 대한 미국 식품의약국(FDA)과의 타입C 미팅 결과가 발표된다. FDA가 요구한 보완자료와 임상 2상 프로토콜을 제출해 FDA로부터 긍정적인 답변이 나오면 바로 임상 2상 진입이 가능할 전망이다. 브릿지바이오는 하반기 중 8개국에서 글로벌 임상시험을 시작하는 것을 계획하고 있다.
|
브릿지바이오 관계자는 “임상 2상을 착실히 준비해왔고 지난해 미팅에서 FDA가 권고한 실험도 무리없이 진행해 왔다”며 “효율적으로 임상 2상을 준비해 FDA의 결과 발표 후 신속하게 임상 2상에 진입할 수 있도록 노력할 것”이라고 말했다.
특발성 폐섬유증은 폐에 반흔조직이 축적돼 딱딱해지면서 폐 기능이 감소하는 원인 미상의 진행성 질환이다. 회복이 불가능한 폐 기능 악화로 결국 호흡 곤란을 초래한다. 세계적으로 인구 10만명당 13~20명이 이 질환을 가지고 있다. 최근 여러 연구에서 고령과 니코틴 제품 소비 증가가 특발성 폐섬유증의 일반적인 진단요인이라고 보고하고 있어 향후 특발성 폐섬유증 치료제 시장은 꾸준히 커질 것으로 예상된다. 시장조사기업인 IMARC는 지난해 32억7800만달러(약 4조원) 규모였던 세계 특발성 폐섬유증 치료제 시장 규모가 매년 성장해 2027년에는 52억6800만달러(약 6조4000억원) 규모에 이를 것으로 예측하고 있다.
하지만 아직까지 이렇다할 치료제가 없는 상황이다. 로슈의 에스브리에트와 베링거인겔하임의 오페브(OFEV, 성분명 닌테다닙)와 같은 기존 IPF 치료제는 증상악화 시점을 늦출 뿐 완전히 치료해주는 것이 아니다.
BBT-877은 지난 2019년 베링거인겔하임에 1조5000억원 규모로 기술이전됐지만 임상 1상 단계에서 1년만에 반환된 선례가 있다. 잠재적 독성 우려가 있다는 것이 당시 기술반환 이유였다. 브릿지바이오는 이에 대해 잠재적 독성 우려가 발견된 것은 약물의 직접적 DNA 손상에 의한 것이 아니라 고농도 약물처리로 인한 세포사멸 기전에 따른 거짓양성이었다고 설명하고 있다. 회사측은 자체 CRO 실험 등을 통해 FDA와 협의해 임상 2상 설계를 더 철저히 하겠다는 계획이다.
회사측에서는 BBT-877의 재기술이전 가능성에 대해서도 조심스럽게 내다보고 있다. 지난달 29일 진행된 기업설명회(NDR)에서 브릿지바이오 관계자는 재기술이전 가능성을 묻는 질문에 “FDA의 긍정적인 답변 이후 임상 2상에 진입하게 된다면 충분히 가능할 것”이라며 “지속적으로 다수 제약사와 파트너십을 논의하고 있다”고 답했다. 특히 업계에서는 베링거인겔하임의 오페브가 2024년 특허 만료를 앞두고 있어 후속 개발물질에 대한 수요가 클 것으로 보고 있다. 최근 갈라파고스가 GLPG-1690을 개발 중단하면서 BBT-877은 지금 시점에서 가장 개발단계가 앞선 오토텍신 저해제가 됐다.
브릿지바이오 관계자는 “오토텍신 저해제 계열 약물을 IPF 치료제로 활용하는 시장이 최근 조명되고 있다”며 “희귀난치질환인 IPF로 고통받는 환자들에게 치료제를 제공할 수 있도록 최선을 다할 것”이라고 했다.




![또 눈 온다 아침까지 강풍에 눈·비…한파 속 빙판길 주의[내일날씨]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24120301248t.jpg)