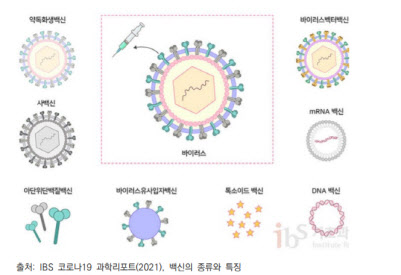
22일 현재 정부가 구매 계약을 체결한 코로나19 백신은 △바이러스 벡터 △mRNA(메신저리보핵산) △재조합 백신으로 세 종류다. 이외에도 재조합과 불활성화 등의 방식이 있는데, 각 국의 상황에 따라 사용되고 있다. 각 플랫폼별 특징을 한국과학기술기획평가원 보고서 등을 참고해 정리했다.
메신저리보핵산(mRNA) 백신
펜데믹 이후 화이자(티커 PFE)와 모더나(MRNA)가 해당 플랫폼으로 백신 개발에 성공하면서 가장 많은 주목을 받았다. 미국은 물론 국내에서도 가장 많이 접종된 백신 플랫폼이다.
항원을 직접 주입하는 대신 몸 안에서 항원 단백질을 만들 수 있는 mRNA를 주입하는 방식이다. mRNA는 일종의 설계도로 체내 단백질 생산 체계에 따라 하나의 분자로 여러개의 단백지을 생산 할 수 있어 백신의 생산과 전달 면에서 효율적이다.
반면, mRNA의 분자 구조가 불안정해 저온으로 유통돼야 하고, 체내 핵산분해효소 등의 공격에는 약해 안정화를 위한 기술이 핵심으로 평가된다.
국내에서는 백신안전기술지원센터와 한국바이오의약품협회를 중심으로 큐라티스와 아이진(185490), 진원생명과학(011000), 보령바이오파마 등이 mRNA 백신 개발을 위해 컨소시엄을 구성했고, 한미약품(128940)과 GC녹십자(006280), 에스티팜(237690)도 컨소시엄을 구성한 바 있다.
|
국내에서 아직까지 접종된 바 없는 플랫폼이다. mRNA 백신과 마찬가지로 항원 단백질을 직접 생산하지 않고, 유전물질을 체내에 주입해 세포가 보유한 단백질 생산 시스템을 활용한다. 바이러스의 염기서열만 알면 신속하고 빠르게 합성 가능하다는 장점도 동일하다.
mRNA에 비해 구조적으로 안정하므로 분해될 우려가 적어 운반, 보관 측면에서 유리하다는 것도 장점이다. 다만 현재까지의 임상 결과로는 항원 생산 및 면역반응・예방효능 등이 낮다는 점이 단점으로 지적되고 있다.
국내에서는 제넥신(095700)과 진원생명과학 이노비오가 DNA 백신을 개발하고 있다. 이중 제넥신과 이노비오는 백신 개발 전략을 추가접종(부스터샷)용도로 변경했다.
바이러스 벡터 백신
국내에서도 접종된 아스트라제네카(AZ)와 존슨앤존슨의 얀센 백신이 바이러스 벡터 플랫폼으로 개발됐다. 국내에서는 셀리드가 해당 방식으로 백신을 개발 중이다.
항원 단백질의 염기서열을 가진 DNA를 아데노바이러스유사바이러스(AAV) 등 인체에 무해한 껍질로 감싸 주입하여 체내에서 항원 단백질을 생산하는 백신이다.
유전자 치료 등의 목적으로 오랜 기간 연구됐고 에볼라 백신이 승인되는 등 어느 정도 안전성이 검증됐다는 장점이 있다. DNA와 mRNA 백신과 마찬가지로 변이 바이러스 발생 시 DNA염기서열만 교체하여 신속하게 대응 가능한 3세대 백신이라는 장점을 갖고 있다.
다만 원하는 항원 외에도 바이러스벡터 자체에 대한 면역반응을 일으킬 우려가 있고, 별도로 바이러스 벡터를 생산해야 한다는 단점이 있다.
재조합 백신
합성항원백신이라고도 한다. 국내에서 재조합 백신이 접종이 안됐지만 향후 접종 가능성이 있다. 정부가 계약한 미국 노바백스의 백신이 재조합백신으로 개발됐다. 국내에서는 SK바이오사이언스(302440)와 유바이오로직스(206650)가 재조합 백신 플랫폼으로 개발 중이다.
유전자 재조합 방식으로 바이러스의 표면항원 단백질만을 생산, 직접 주입해 면역반응을 유도하는 방식이다. 오랜기간 사용돼 안전성과 신뢰성이 높다는 장점이 있다.
다만 일반적으로 면역원성이 생백신이나 사백신에 비해 떨어지므로, 면역반응 강화를 위해 다양한 면역증강제(adjuvant)와 함께 투여한다는 점은 단점이다.
사백신(불활성화 백신)
감염을 일으키는 바이러스나 미생물을 주로 포름알데히드 등 화학적 처리를 통해 사멸시켜 체내에 주입하는 방식이다.
중국의 국영 제약회사인 시노팜과 시노백이 해당 플랫폼으로 코로나19 백신을 개발했따. 하지만 관련 과학적 증거를 공개하지 않는 등 안전성에 대한 논란 존재한다.
남미와 동남아 등 개발도상국을 중심으로 사용됐으나 최근 이들 국가도 화이자와 모더나 백신 확보가 용이해지면서 상대적으로 외면을 받고 있다.