최근 의료 및 건강분야에서 디지털을 활용하는 것을 넓은 의미로 디지털헬스로 칭하고 있지만, 증거에 기반해 진단, 치료, 예방완화 사용을 목적으로 한 제품은 ‘소프트웨어의료기기(SaMD), SaMD 중 유효성을 입증하고 치료개입을 제공하는 것이 ’디지털치료제(DTx)로 불린다.
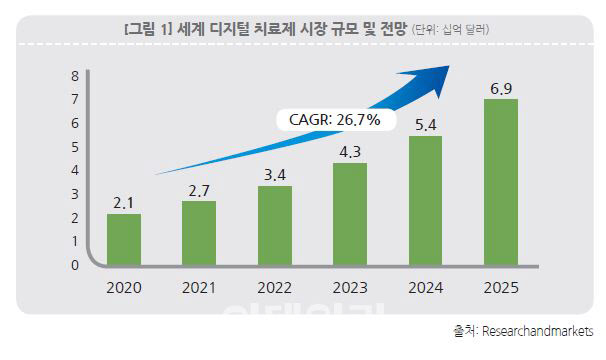
전 세계 디지털치료제 시장은 2020년 21억 달러에서 연평균 26.7% 성장해 2025년 69억 달러에 이를 것으로 예상된다. 디지털치료제는 화학적 작용이나 기기를 통한 물리적 작용만으로는 실현하지 못하는 디지털이기 때문에 가능한 새로운 작용을 통해 치료 효과를 초래하고, 데이터 수집 및 분석이 비교적 용이하다.
또한 데이터 집적 및 SW 업데이트를 통한 기능향상을 기대할 수 있는 특성을 보유하고 있다. 디지털치료제는 개별화된 지속적인 개입을 통한 치료효과 향상, 환자정보 취득·파악 등 치료효과의 개별 최적화에 기여하고, 의사의 부담 경감, 의료 경제력 효과 등 비용절감에도 기여한다.
디지털 치료는 치료 유효성과 안전성에 대한 증거를 제시해야 하고, 치료용 앱은 데이터 보안 확보, 범용기기 OS 업데이트, 디지털 관련 규제 대응 등을 고려한 새로운 심사·승인제도가 필요하다. 때문에 세계 각국은 디지털 치료 혁신을 촉진하기 위해 대책을 마련하고 있다.
|
영국은 국립의료기술평가기구(NICE)가 국민건강서비스(NHS)를 통해 치료용 앱 보험적용과 표준적인 증거에 대해 정보를 제공하고 있다. 또한 치료용 앱 개발 및 평가 관점에서 NHS와 NICE가 상호 연계하며 가이던스 실효성을 높이는 대책을 마련 중이다.
영국 보건부는 지난 1월 디지털·데이터 헬스 기술의 적정 가이드를 발표해 편리함, 데이터 이용에 관한 윤리원칙, 제품가치, 기술보증, 임상적 안전성, 사이버보안 등에 대한 평가시점과 법적 가이던스를 확보했다.
◇독일
독일은 치료용 앱 패스트트랙 제도를 운영 중이다. 이 제도는 등록요건을 충족하면 신청 후 3개월 내 신청한 앱이 처방 가능한 치료용 앱으로 국가 DB에 등록되며, 보험적용 가격도 결정된다. 디지털치료제 개발사는 패스트트랙 가이드라인을 참고로 △안전성과 사용적합성 △데이터 보호 및 정보보안 △품질, 데이터 상호운용성 △임상효과 등록요건을 신청한다. 4가지 모두 충족된 경우 본등록이 가능하다.
◇중국
중국은 2017년 12월 이동 의료기기등록기술심사 가이드라인 공고를 통해 프로그램을 의료기기로 등록할 수 있는 환경을 정비했다. 하지만 디지털 치료 관련 제품이 출시되지 않아 디지털치료제로 특화된 시책 없이 정책검토 작업을 가속화 할 것으로 예상된다. 지난해 11월에는 ‘원격 모니터링 하에서의 운동이 2형 당뇨병 환자의 예후에 미치는 영향’에 대한 임상연구 성과를 바탕으로 개발된 앱을 중국 최초로 쓰촨성이 치료용 앱으로 승인한 바 있다.