'램시마' 이어 '트룩시마' '허쥬마' 잇따라 성공
다양한 임상시험으로 효과 입증에 주력
피하주사형 램시마·독감치료제 등 신약 개발
 | | 셀트리온 서정진 회장. |
|
[이데일리 정태선·강경훈 기자] 이보다 멋진 ‘미운 오리 새끼’가 있을까. 세계 최초로 항체 바이오시밀러(생물학제제 복제약)를 개발한
셀트리온(068270) 얘기다. 2002년 설립한 셀트리온은 2013년 바이오시밀러 ‘램시마’를 유럽에 선보이기 전까지 ‘제약업 경험도 없는 사람들이 무슨 수로 바이오시밀러를 개발하냐’ ‘설령 만든다고 한들 어떤 의사가 써줄까’ 등 수 없는 ‘편견’에 시달려야 했다. 하지만 세계 최초 항체 바이오시밀러인 ‘램시마’(미국 판매명 인플렉트라)를 시작으로 유럽에서 출시한 혈액암 항암제 ‘트룩시마’, 유럽과 미국에서 시판을 기다리고 있는 유방암 치료제 ‘허쥬마’로 이어지는 잇단 바이오시밀러의 성공으로 셀트리온을 바라보는 시각은 180도 바뀌었다. 이제는 시가총액 약 27조 3400억원의 글로벌 헬스케어 기업으로 당당하게 자리매김했다. 셀트리온이 지난해 7월부터 내보내는 TV광고에서 전하는 메시지는 ‘실패를 딛고서 묵묵히 달리기’ ‘편견의 말들과 반대로 달리기’ ‘신념이 있으면 꿋꿋이 달리기’ 등이다. 이 광고 카피는 서정진 셀트리온 회장이 직접 관여한 것으로 알려져 있다. 글로벌 제약사나 바이오 전문가들 모두가 항체 바이오시밀러는 어렵다고 단정할 때, 무모하게 뛰어들어 보란 듯 성공한 서 회장만이 쓸 수 있는 카피라는 게 업계 중론이다. 약 전문가는 아니지만 ‘뚝심’ 하나만큼은 인정할 수밖에 없다는 뜻이다.
‘램시마’, 유럽 이어 미국시장 공략 본격화
 | | 램시마. |
|
오늘날 셀트리온이 있게 한 일등공신은 단연 ‘램시마’다. 램시마는 항체를 이용해 면역시스템 신호전달에 관여하는 단백질이나 암 표지인자를 공격하는 항체의약품 바이오시밀러다. 2013년 유럽의약품청(EMA) 승인 후 유럽에서 판매하기 시작했다. 램시마는 오리지널약과 비교해 효능은 동등하지만 가격은 20~30% 저렴한 이유로 유럽시장에서 출시 초기부터 큰 호응을 얻었다. 출시 9개월만에 램시마를 처방 받은 환자 수가 6만명을 넘어섰고 지난해 2분기 기준으로는 오리지널약 시장의 약 46%를 대체했다. 셀트리온은 류마티스관절염뿐 아니라 염증성장질환, 크론병 등 관련 질환에 대한 임상시험을 꾸준히 진행해 관련 연구결과를 꾸준하게 발표했다. 이런 노력 덕에 영국 국립보건임상연구소(NICE)는 램시마 우선 사용을 장려하는 권고안을 제시하기도 했다.
램시마는 2016년 4월 미국식품의약국(FDA)으로부터 허가를 받아 현지에 진출하는 등 지금까지 83개 국가에서 승인을 받았다. 셀트리온은 램시마 등 의약품 수출로는 국내 최초로 ‘3억불 수출의 탑’을 수상했다.
◇‘트룩시마’, 출시 3개월만에 영국 등서 점유율 30% 돌파
셀트리온의 2호 바이오시밀러인 ‘트룩시마’는 지난해 2월 EMA 승인을 받고 4월 유럽에 본격 출시했다. 트룩시마는 영국과 네덜란드에서 출시 석달 만에 오리지널약인 리툭산 시장의 30% 이상을 잠식했고 이후 매달 10% 이상 매출이 늘고 있다. 셀트리온 관계자는 “트룩시마가 램시마보다 성장속도가 3~4배 더 빠르다”고 기대를 감추지 않았다.
트룩시마의 빠른 성장은 단순히 가격경쟁력만으로는 설명할 수 없다. ‘삶의 질’이 문제인 자가면역질환과 달리 암은 생명과 직결돼 있어 항암제는 가격보다 효능을 우선시한다. 김형기 셀트리온 사장은 “관련 학회에서 트룩시마 임상시험 결과를 꾸준히 발표하는 등 의료진에게 신뢰를 얻기 위한 많은 노력을 기울였다”고 말했다. 트룩시마는 현재 FDA 승인 심사 절차를 밟고 있으며 이르면 올해 상반기에 FDA 승인을 받을 것으로 예상된다. 이럴 경우 유럽에 이어 미국에서도 리툭산 ‘퍼스트무버’로 자리 잡게 된다.
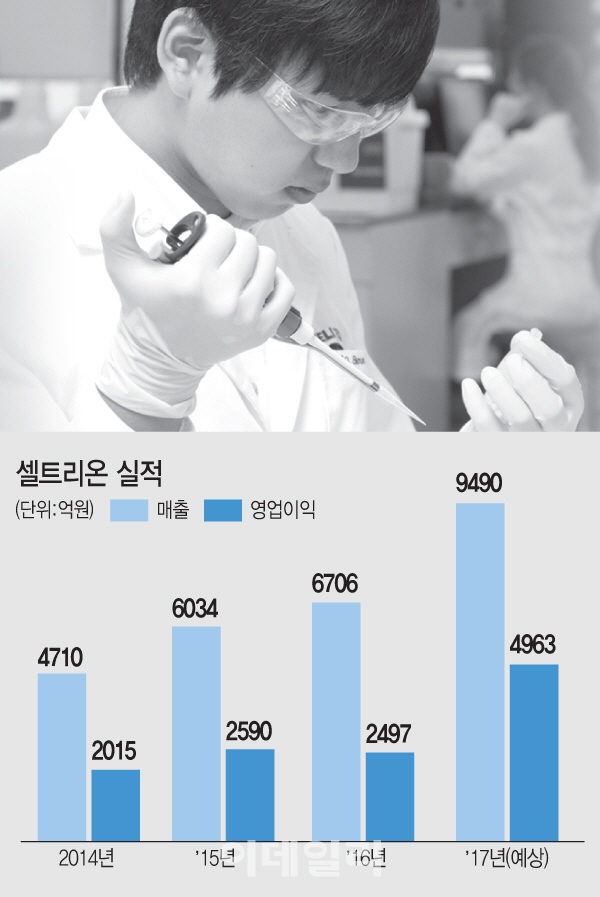 | | [이데일리 이미나 기자] 셀트리온 실적 |
|
 | | 셀트리온 공장 전경. |
|
‘허쥬마’ 유럽 출시 임박..글로벌 론칭 일정대로 ‘순항 중’
 | | 허쥬마 |
|
셀트리온은 지난해 8월 세번째 바이오시밀러인 ‘허쥬마’를 국내에 출시했다. 2014년 1월 식품의약품안전처 허가를 받은 지 3년 만이다. 유럽에서는 지난해 12월 EMA 산하 약물사용자문위원회(CHMP)로부터 ‘허가승인 권고’를 받고 올해 상반기 중 공식 허가를 예상하고 있다. 미국에서도 허가 심사 중이다. 허쥬마가 미국과 유럽에서 본격 출시되면 램시마와 트룩시마처럼 오리지널약 시장을 빠르게 대체할 것으로 기대된다.
셀트리온은 단순히 바이오시밀러 개발에만 집중하지 않는다. 서정진 회장은 기자간담회에서 “바이오시밀러를 넘어 자체 바이오신약 개발을 목표로 연구개발 역량을 확대하고 있다”며 신약 개발 포부를 드러내기도 했다.
가장 개발이 빠른 것이 램시마 제형을 개선한 바이오베터 ‘램시마SC’다. 램시마는 정맥주사이기 때문에 2주에 한 번씩 환자가 병원을 찾아야 한다. 램시마SC는 이를 피하주사 형태로 개선한 것으로, 완성할 경우 환자가 병원을 찾을 필요 없이 집에서 스스로 주사 처치를 할 수 있다. 현재 셀트리온은 램시마SC에 대한 글로벌 임상 3상시험을 진행 중이다.
독자 신약도 개발 중으로 현재 세계 최초 종합 독감 항체치료제(CT-P27)에 대한 국내 및 글로벌 임상2b상을 진행 중이다. 또 독감·간염·광견병 등 각종 감염성 질환에 대한 항체 치료제 및 백신을 개발하고 있다. 김형기 사장은 “기술융합을 통해 항체에 합성의약 물질을 결합해 부작용은 최소화하고 치료 효과는 극대화한 차세대 바이오 신약(ADC, 항체·의약품 접합)을 개발하는 등 다양한 신약들을 연구하고 있다”고 덧붙였다.
 | | [이데일리 이미나 기자] 셀트리온 허가 현황 |
|














