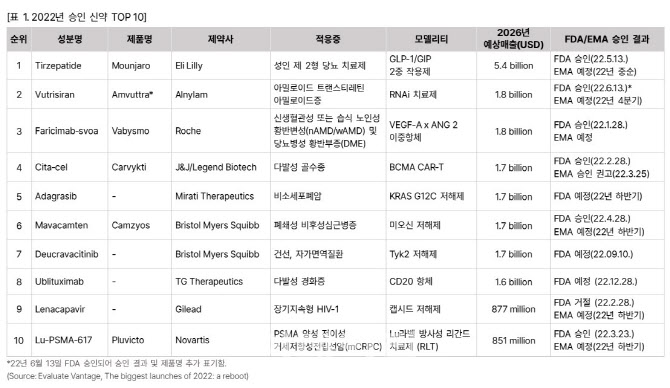
리포트에 따르면 올해 승인 기대 신약 TOP10에 선정된 신약은 △당뇨 치료제 티제파티드(일라이 릴리) △아밀로이드 치료제 부트리시란(앨라일람) △황반변성 치료제 파리리맙-스보아(로슈) △다발성 골수종 치료제 실타셀(존슨앤드존슨) △비소세포폐암 치료제 아다그라십(미라티 테라퓨틱스) △폐쇄성 비후성심근병증 마바캄텐(BMS) △자가면역질환 치료제 듀크라바시티닙(BMS) △다발성 경화증 치료제 유블리툭시맙(TG테라퓨틱스) △장기지속형 HIV-1 치료제 레나카파비르(길리어드) △전립선암 치료제 Lu-PSMA-617(노바티스)등이다. 하지만 이 중 3개 신약들은 다양한 문제로 승인에 난항을 겪고 있다.
|
BMS는 암젠에 매각한 오테즐라(Otezla)에 대항하기 위해 건선 치료제 듀크라바시티닙을 개발했다. 현재 미국 식품의약국(FDA)의 승인 결과를 기다리고 있다. 듀크라바시티닙은 자가면역질환 치료제로 개발 중인 JAK 계열 첫 TYK2 저해제다. TYK2 조절 도메인에 결합해 자가면역 질환 원인인 IL-23과 IL-12, 인터페론 1형의 신호전달을 저해한다.
경구용과 주사제로 개발 중인데 경구용은 중등에서 중증 건선 환자를 대상으로 한 2개의 임상 3상에서 오테즐라보다 우월한 효능과 안전성을 보여줬다. 임상 결과를 바탕으로 FDA 승인을 신청한 상태이며, 9월 10일까지 해당 적응증에 대한 판단이 내려질 예정이다. 반면 주사제는 상황이 좋지 못하다. 경쟁 제품인 코센틱스(노바티스), 탈츠(일라이 릴리), 스카이리지(애브비) 대비 더 낮은 증상 완화 비율을 보였다. 특히 지난해 12월 FDA는 JAK 저해제가 심장질환 및 종양 등의 부작용 발생 위험을 인정하며 JAK 저해제 사용을 제한했다. 따라서 FDA의 안전성 주의 조치가 JAK 계열인 TYK2를 타겟하는 듀크라바시티닙의 승인 여부가 불투명한 상태다.
다발성 경화증 치료제 유블리툭시맙
TG 테라퓨틱스는 CD20 항체 의약품후보물질 유블리툭시맙을 재발성 다발성 경화증을 적응증으로 FDA에 승인 신청을 한 상태이다. 유블리툭시맙은 B세포 수를 감소시켜 과다한 면역반응을 억제하는 방식으로 자가면역반응을 저해한다. 임상 3상에서 피리미딘 합성을 막아 면역세포 양을 저하시켜 면역반응을 억제하는 기전을 가진 오바지오(사노피) 대비 우수한 효능을 보였다. 하지만 9월 말로 예정돼 있던 FDA 승인 일정은 12월 말로 연기됐다. TG 테라퓨틱스는 심사기간 연장 이유에 대해 구체적인 언급은 피하면서도, FDA가 주요 수정 사항으로 요청한 추가자료 검토를 위함이라고 발표했다.
HIV 치료제 레나카파비르
HIV 치료제 시장에서 오랫동안 독보적인 위치를 차지해온 길리어드가 가장 가치 있는 자산으로 평가하는 것이 바로 레나카파비르다. 이 치료제는 6개월에 한번 투여하는 장기지속형 HIV-1 캡시드 저해제다. HIV 바이러스 유전 물질을 보호하는 캡시드 단백질 활동을 방해해 바이러스 복제를 저해하는 효과가 있다. FDA로부터 혁신신약 지정을 받았다. 다제내성 HIV 환자들을 대상으로 한 임상 2/3상에서 전체 환자 80%에서 체내 바이러스 양이 연구실에서 감지 불가한 수준까지 줄어든 것으로 나타났다. 경구용과 주사제형으로 개발 중이다.
길리어드는 지난해 6월 FDA에 승인 신청을 했지만, 올해 안에 승인은 힘들 것으로 보인다. FDA는 지난해 12월 유리 바이알이 포장되는 주사제형에 대해 미세 유리입자가 형성될 위험이 높다고 판단해 주사제형 레나카파비르를 활용한 길러어드 HIV 임상 10건에 대해 일제히 중단 명령을 내렸다. 올해 3월에는 동일한 문제에 대해 현 상태로는 중대 결격 사유가 있어 허가할 수 없다는 레터를 보낸 바 있다. 길리어드는 유리 바이알을 바꾼 뒤 지난 6월 FDA에 보완 자료를 제출했다.








![[단독] “뭐라도 해야죠”…박나래, 막걸리 학원서 근황 첫 포착](https://image.edaily.co.kr/images/vision/files/NP/S/2026/01/PS26012300805t.jpg)