자가골수유래중간엽 줄기세포를 주성분으로 하는 전문의약품으로 지난 2014년 식품의약품안전처(식약처)의 조건부 품목허가를 받은 뉴로나타-알주는 이듬해 2월 말부터 환자 투약이 개시됐다. 하지만 조건부 허가 때부터 추진했던 보험등재는 건강보험심사평가원(심평원)과의 합의 불발로 이뤄지지 못했다.
김 대표는 “희귀질환 치료제는 경제성 평가가 필수가 아니었지만 경제성 평가를 직접 진행해 관련 분석 자료를 토대로 심평원과 협의했다. 하지만 제시한 자료를 제시했음에도 심평원에서 너무 낮은 약값을 제시했고 이를 받아들이면 회사 운영이 불가능할 수준이었다”며 “당시 회사에서는 생산원가 수준으로만 약값을 책정해도 합의에 응하겠다고 했지만 결국엔 (합의에) 이르지 못했다”고 설명했다.
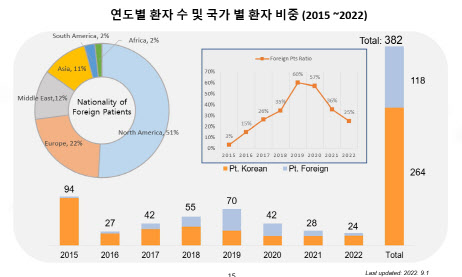
대신 회사는 국내 환자들에 비해 상대적으로 약값 저항성이 낮은 사보험에 가입된 외국인 환자들에게 눈을 돌렸다. 그는 “뉴로나타-알주와 같은 개인 맞춤형 바이오 분야는 국내 시장 규모가 너무 작아 신약개발사는 무조건 글로벌 시장을 타깃으로 해야 한다는 것을 배웠다. 미국 식품의약국(FDA)에 임상시험계획(IND)을 신청하게 된 것도 이 때문”이라고 했다.
|
뉴로나타-알주는 1년에 총 5번 주사를 맞도록 돼 있다. 현재 국내에서는 주사 한 회당 4000만원 수준으로 약값(비보험)이 책정돼 있다. 이는 임상 3상 전 조건부 허가 상태에서의 약값이기 때문에 추후 임상 3상을 마치면 약값 설계가 다시 이뤄질 수 있다. 회사측에서는 북미지역 진출시 한 회당 약 1억원, 연간 총 5억원의 악값을 적정가격으로 생각하고 있다.
이어 김 대표는 “국내에서 너무 낮은 가격에 보험수가가 결정되면 향후 미국이나 유럽에서 해당 약을 출시할 때 보험수가 합의에 걸림돌이 될 수 있다”며 “임상 3상을 마친 뒤 미국에서 먼저 보험등재를 하고 그 가격을 기준으로 다시 심평원과 합의할 것”이라고 했다. 코아스템은 2024년경 임상 3상 결과를 도출해 FDA에 품목허가를 신청할 계획이다.
FDA의 품목허가를 기다리고 있는 바이오젠의 ‘토퍼센’ 시판이 결정되면 뉴로나타-알주 예상 매출액에 영향이 없겠냐는 질문에도 코아스템은 자신감을 드러냈다. 뉴로나타-알주를 비롯해 현재 시판 중인 루게릭병 치료제들은 완치제가 아니라 질병의 진행속도를 늦춰 기대수명을 늘리는 약으로 알려져있다. 반면 토퍼센은 최초의 루게릭병 치료제를 목표로 개발 중이다.
회사 관계자는 “토퍼센은 루게릭병 환자 중에서도 특정 유전자인 과산화물제거효소1(SOD1) 유전자 관련 질환을 가진 환자들에게서만 쓸 수 있도록 개발된 약물”이라며 “전체 루게릭병 환자 중 타깃 환자 비중이 2%에 불과하다”고 설명했다.
이어 김 대표는 “루게릭병 환자의 10% 가량은 유전성이고 나머지 90%는 산발성·치매성으로 알려져 있는데 뉴로나타-알주가 타깃하는 환자는 이 90%에 해당한다”며 “토퍼센이 품목허가를 받아 시장에 출시되더라도 아예 타깃 환자군이 다르고 그 규모도 작아 전체 루게릭병 치료제 시장에 미칠 영향은 미미할 것으로 본다”고 했다.
![韓증시, 트럼프 관세 압박…“노이즈 버텨야”[오늘증시전망]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112700266t.jpg)



