|
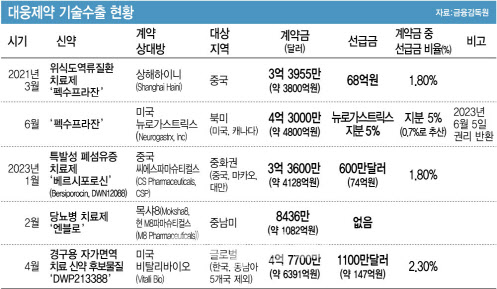
◇기술이전 계약금 1조원 중 선급금은 221억원
대웅제약은 지난 1월 씨에스파마슈티컬스(CS Pharmaceuticals, CSP)와 3억3600만달러(4130억원) 규모의 특발성폐섬유증 치료제 ‘베르시포로신(Bersiporocin, DWN12088)’ 기술이전 계약을 체결했다. 지난 2월에는 당뇨병 치료제 ‘엔블로’를 M8파마슈티컬스(M8 Pharmaceuticals, 전 목샤8(Moksha8))에 8436만달러(약 1082억원)에 수출했다. 지난 4월에는 경구용 자가면역 치료제 ‘DWP213388’을 4억7700만달러(약 6391억원)에 미국 비탈리바이오(Vitalli Bio)에 기술이전했다.
이 중 베르시포로신과 DWP213388의 기술이전 계약 선급금(upfront)은 각각 600만달러(약 74억원), 1100만달러(약 147억원)다. 이는 전체 계약금 대비 각각 1.8%, 2.3%에 해당하는 규모다. 올해 상반기 1조원대 기술이전 계약을 체결했지만 선급금으로 받은 금액은 221억원뿐(2.1%)인 셈이다. 통상적으로 기술이전 계약에서 선급금 규모가 5% 이상이어야 안정적인 계약으로 평가된다.
이승규 한국바이오협회 부회장은 “기술이전 계약 규모가 커지면 선급금 규모가 적어지는 경우도 있지만 이런 경우에도 선급금 비율은 2%~5% 사이가 적정하다”며 “선급금이 5% 이상인 것이 일반적이지만 라이선스아웃에는 다양한 구조가 있기 때문에 파트너사가 해당 파이프라인으로 임상을 추진할 수 있는 능력이 충분한지가 중요하다”고 지적했다.
대웅제약과 기술이전 계약을 체결한 해외 파트너사들은 설립된 지 5년 미만이고 임직원수가 적은 비상장사들이라는 공통점을 갖는다. 최근 4억3000만달러(약 4800억원) 규모의 위식도역류질환 신약 ‘펙수프라잔’ 기술수출 계약을 해지한 미국 뉴로가스트릭스의 기업가치가 800억원 규모로 추정된다는 점도 해외 파트너사에 대해 들여다보게 하는 요소다.
◇씨에스파마는 어떤 곳?
지난 1월 베르시포로신을 기술도입한 씨에스파마슈티컬스는 영국에 본사를 두고 있지만 베이징과 상하이에도 지사가 있는 중국계 회사다. 씨에스파마슈티컬스는 중국에 의약품 임상·상업화를 책임지거나 중국 의약품을 서구에서 상용화하는 것을 목표로 한다. 중국에서 미충족 수요가 높은 희귀질환과 안과질환에 초점을 두고 후기 단계 파이프라인을 구축한 게 특징이다. 글로벌 시장조사업체 피치북에 따르면 2020년 설립됐으며 임직원수는 7명 수준이다.
베르시포로신은 지난 2월 글로벌 임상 2상 첫 투약을 개시했으며 내년 상반기에 임상을 마칠 예정이다. 베르시포로신은 지난해 7월 미국 식품의약국(FDA)으로부터 패스트트랙으로 지정됐기 때문에 임상 2상 완료 이후 가속 승인과 우선 심사 신청이 가능하다. 씨에스파마슈티컬스는 중국 임상과 인허가를 담당할 것으로 보이지만 아직 임상 관련 계획은 밝힌 바 없다.
대웅제약 관계자는 “해당 계약이 중화권 계약이라는 점에서 일각에선 평가절하하기도 했지만 씨에스파마는 경영진들이 영국 쪽 사람들”이라고 강조했다.
◇기술수출 계약 후 의혹 일었던 비탈리바이오
비탈리바이오는 4억7700만달러(약 6391억원) 규모의 DWP213388 기술이전 계약 체결 소식 이후 국내 시장에서 의혹의 눈초리를 받던 업체다. 설립 시기가 올해 1월이라 실체가 의심된다는 이유에서다. 이러한 의구심은 비탈리바이오가 애디텀바이오(Aditum Bio)가 9번째로 출범한 자회사라는 게 알려지면서 누그러졌다.
애디텀바이오는 2019년 노바티스 출신 2명이 공동 창립한 제약바이오 전문 벤처캐피탈(VC)로 스핀 아웃(spin out) 모델을 통해 신약의 시장 출시 속도를 높이는 것을 목표로 하고 있다. 또한 소프트웨어 기술을 활용해 기존 제약사보다 빠르고 저렴한 비용으로 임상을 진행한다. DWP213388은 지난해 8월 FDA로부터 1상 임상시험계획(IND) 승인을 받은 상태다. 비탈리는 해당 신약 이름을 ‘VIT-801’로 바꾸고 내년에 미국 임상 1상에 돌입할 예정이다.
해당 업체들은 임직원수가 50명 미만으로 적고 설립된 지 5년 미만이라는 공통점이 있다. 글로벌 임상을 추진할 자금력이 충분하지 못할 수 있다는 우려가 나오는 대목이다. 이에 대해 대웅제약 측은 “단순히 신약개발사의 임직원 수만으로 해당 업체의 경쟁력을 판단하긴 어렵다”고 답했다.
바이오업계 관계자는 “바이오텍은 해당 인력이 어느 정도 전문성을 갖췄는지가 중요하기 때문에 임직원수가 적다는 것만으로 해당 기업에 문제가 있다고 단정지을 순 없지만 10명 미만이면 면밀히 들여다볼 필요는 있다”고 언급했다.
한편 펙수프라잔 수출 계약의 물꼬를 텄던 M8 파마슈티컬스가 지난 2월 엔블로 수출 계약을 맺은 점도 눈에 띈다. M8 파마슈티컬스의 2020년 1월 펙수프라잔 수출 계약 이후 5개사와 잇따라 펙수프라잔 계약을 체결한 바 있다.
M8 파마슈티컬스는 지난해 10월 리브랜딩하면서 사명을 변경했다. 직원수가 수백명대인 업체로 신약개발사라기보다는 중남미에 제품 등록·상업화를 돕는 제약사에 가깝다. 이 때문에 제품 출시가 임박했거나 완료된 신약들을 수출하는 계약을 잇따라 체결한 것으로 풀이된다. 펙수프라잔은 2021년 12월 식품의약품안전처로부터 품목허가를 받고 지난해 7월 국내 출시됐다. 엔블로는 지난 1월 국내 출시된 국산 신약 36호다.
바이오업계 관계자는 “신약 개발이 어느 정도 완료된 상태에서 수출 계약을 체결한 경우에는 해외 유통을 염두에 두고 선급금 비율을 낮추고 로열티 비율을 높일 수도 있다”며 “이런 계약의 경우 파트너사의 임상이나 신약개발 역량에 대해 검증할 필요는 없을 것”이라고 진단했다.


![저수지에 떠오른 검은색 가방…네살 배기 시신이었다 [그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24120300003t.jpg)

