지노믹트리(228760) 관계자가 내놓은 방광암 진단시장 전망이다. 지노믹트리는 현재 자사 방광암 진단키트 ‘얼리텍®-BCD’에 대해 미국 보건복지부(HHA) 산하 미국보험청(CMS)에 보험 급여 코드 발급 절차를 밟고 있다.
|
지노믹트리의 방광암 진단키트는 소변을 이용하면서도 정확도는 요도 내시경과 유사한 수준으로 평가받는다.
지노믹트리 방광암 진단키트는 기술력을 인정받아 국내 의료기기 최초로 지난 4월 미국 식품의약국(FDA)으로부터 ‘혁신의료기기 지정’(Breakthrough Device Designation, BDD)을 받았다. 혁신의료기기로 지정된 의료기기는 FDA 승인 절차의 우선순위를 확보해 신속승인이 이뤄진다.
방광암 검사, 소변 진단키트 개발 경쟁 심화
이대로면 글로벌 방광암 진단 시장을 통째로 삼킬 것이란 전망이 나오고 있다. 사실상 변변한 경쟁자가 없단 분석이다.
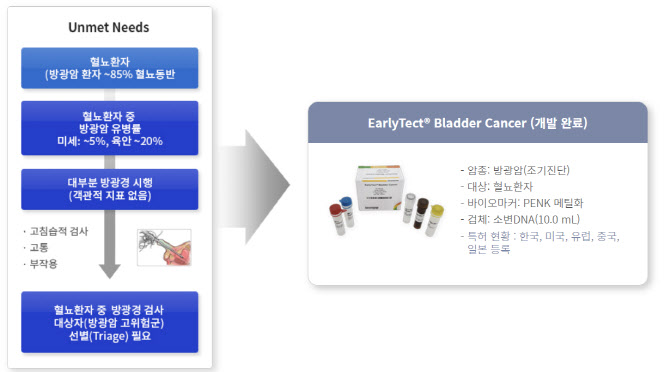
지노믹트리 관계자는 “방광암 검사는 고침습적 검사로 상당히 고통스럽다”면서 “문제는 비침습 방식인 요세포 검사 정확도(민감도)가 35% 수준에 그쳐, 요도에 바늘 모양의 내시경을 삽입하는 ‘방광경’ 검사 외 대안이 없다”고 설명했다.
요세포 검사는 가는 바늘로 요도 부위를 찔러 세포를 추출하는 방식이다. 추출한 세포를 현미경으로 관찰에 암세포 유무를 가려낸다.
그는 이어 “더 큰 문제는 방광암 환자의 50%는 2년 내 재발한다”면서 “3개월 마다 방광경 검사를 통해 추적관찰을 해야 한다. 하지만 환자들이 극심한 고통에 검사를 회피한다”고 말했다.
미국의 방광암 진단키트 시장규모는 35억달러(한화 약 4조 7000억원) 정도로 추산된다. 이런 시장 상황에서 소변 검사를 이용한 방광암 검사 시장 개발 수요는 두텁게 형성됐다. 지노믹트리 관계자는 “글로벌 진단키트 업체들이 우후죽순 소변 방광암 진단키트 개발에 나선 배경”이라고 부연했다.
지노믹트리, 정확도 가장 우수
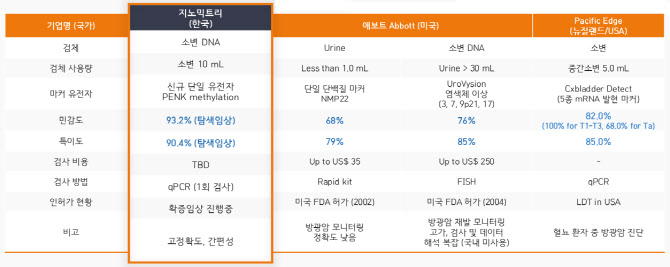
미국 ‘애보트’(Abbott), 뉴질랜드 ‘퍼시픽 엣지’(Pacific Edge) 등이 소변 방광암 진단키트를 개발해 시장에 내놨다. 특히, 애보트사는 각기 다른 2개 제품을 출시했다. 그럼에도 이들 제품은 낮은 정확도로 시장 선점엔 실패했다.
애보트의 2개 제품은 민감도가 각각 68%, 76%에 그친다. 방광암 환자 10명 중 7명 정도만 정확하게 진단했단 얘기다. 퍼시픽 엣지의 진단키트 정확도는 82%로 이전 제품보다 높았지만 의료현장에선 정확도가 낮다는 불평이 쏟아졌다. 그 결과, 미국보험청은 지난달 퍼시픽 엣지의 방광암 진단키트에 대해 보험코드 삭제를 결정했다. 미국보험청은 이같은 결정에 “유의성이 없다”는 이유를 내세웠다.
지노믹트리 관계자는 “현재 애보트의 진단키트는 민감도가 60%대에 그쳐 의료 현장에서 사실상 퇴출된 상태”라며 “퍼시픽 엣지 제품도 임상 결과와 실제 의료현장에서의 간극이 큰 것으로 파악됐다”고 진단했다.
|
반면, 지노믹트리의 방광암 진단키트는 높은 정확도를 자랑한다. 705명을 대상으로 한 임상에서 민감도 93.2%, 특이도 90.4%를 각각 기록했다. 앞선 제품들 대비 민감도 최대 25%, 특이도 최대 11% 이상 높은 수치다. 방광암 환자와 방광암 의심 환자 모두에서 높은 정확도를 나타냈단 얘기다.
지난달 서비스 개시...2025년 허가로 퀀텀점프 예고
지노믹트리는 지난달 방광암 진단키트 ‘얼리텍®-BCD’ 분석서비스를 미국에서 개시했다. 얼리텍®-BCD의 미국 분석서비스는 미국 자회사 ‘프로미스 다이애그노스틱스’(Promis Diagnostics, PDX,)의 ‘자체개발 진단검사’(LDT)를 통해 진행 중이다. LDT 서비스는 FDA 품목허가 전 시범 서비스로, 클리아랩(CLIA LAB) 지정센터에서만 검사가 가능하다.
급여코드 등록이 된다면 매출 증가 속도는 가팔라질 전망이다. 급여 코드는 메디케어 등의 보험 급여 청구 절차 간소화해, 방광암 진단키트 매출 급증을 일으키기 때문이다.
본격적인 매출 발생 시점은 2025년이 될 전망이다. 지노믹트리 관계자는 “LDT 서비스와 별개로 올 하반기 FDA 허가용 확증 임상을 개시할 예정”이라며 “내년 임상을 끝내고 분석 절차를 마무리할 계획이다. 오는 2025년경 ‘얼리텍®-BCD’에 대해 FDA 품목허가를 신청할 계획”이라고 밝혔다.
지노믹트리는 국내에선 9개 기관에서 방광암 진단키트에 대해 3453명을 대상으로 국내 제조허가용 임상을 진행 중이다.
그는 “지노믹트리와 같이 미국 LDT 서비스 제도를 활용해 소변 방광암 진단키트 상용화 승인을 받은 퍼시픽 엣지 주가는 2020년 2분기 이후 2년 만에 10배 폭등했다”며 “미국 내 소변 방광암 진단키트 시장 수요가 많다는 반증”이라고 강조했다. 이어 “최근 퍼시픽 엣지 급여가 취소됨에 따라, 지노믹트리가 미국 소변 방광암 진단키트 시장을 통째로 차지할 가능성이 높다”고 내다봤다.



!['36.8억' 박재범이 부모님과 사는 강남 아파트는[누구집]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26021500062t.jpg)
