|
22일 이데일리가 EMA의 신약 채널을 종합분석한 결과에 따르면, 올해 1월부터 이날까지 유럽에서 13종의 신약이 품목 허가됐다. 이중 5종이 세포·유전자치료제나 유전자치료제로 유럽에서는 첨단 생명공학기술이 접목된 신약의 등장이 두드러졌다는 평가다.
세포유전자치료제는 일반 세포치료제와 유전자 변형을 완료한 세포치료제 등을 포함하는 개념이다. 최근 화제를 모으고 있는 ‘키메릭항원수용체’(CAR)-T 치료제도 여기에 포함된다. 또 유전자 치료제는 질병 치료 등을 목적으로 인체에 투입하는 유전물질 또는 이런 물질을 포함하고 있는 의약품을 말한다.
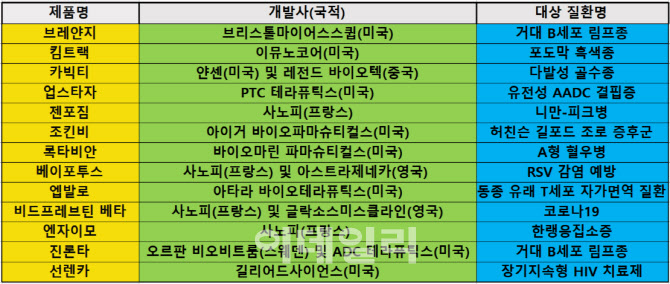
EMA는 지난 3월 미국 얀센과 중국 레전드 바이오텍이 공동개발한 다발성 골수종 치료제 ‘카빅티’(성분명 실타캅타진 오토류셀)를 시작으로, 미국 브리스톨마이어스스큅(BMS)의 B세포 림프종 치료제 ‘브레얀지’(성분명 리소캅타진 마라류셀, 4월)와 미국 아타라 바이오테라퓨틱스의 동종 유래 T세포 자가면역질환 치료제 ‘엡발로’(성분명 타벨레클레우셀, 12월) 등을 잇따라 승인했다.
이중 카빅티와 브레얀지는 CAR-T치료제이며, 엡발로는 T세포 치료제다. 카빅티는 B세포성숙항원(BCMA)을 타깃하는 두 번째 CAR-T치료제다. 엡발로는 올해의 끝자락인 지난 19일(현지시간) 승인됐다. 고형 장기 이식 또는 조혈모 세포이식 수술 후 나타나는 T세포성 자가면역질환 치료제로 알려졌다.
올해 유럽에서 승인된 유전자 치료제로는 △미국 PTC 테라퓨틱스의 ‘방향족 L-아미노산탈산산효소 결핍증(AADC)’ 치료제 ‘업스타자’(7월) △미국 바이오마린 파마슈티컬스의 A형 혈우병 치료제 ‘록타비안’(성분명 발록토코진 록사파보벡, 8월) 등이 있다. 업스타자와 록타비안은 모두 해당 희귀 유전질환 대상 최초의 치료제로 기록됐다.
이에 더해 EMA가 내년 중 가장 빠르게 신약으로 승인할 약물 역시 유전자 치료제일 가능성이 높아지고 있다. 지난 16일(현지시간) EMA 약물사용자문위원회(CHMP)는 호주 CSL베링의 B형 혈우병 치료제 ‘헴제닉스’(성분명 에트라나코진 데자파보벡)를 조건부 승인 권고했다고 발표했다. 헴제닉스는 지난 11월 미국에서 승인됐다. 투여 비용이 350만 달러(약 47억원)로 책정돼 현존하는 약물 중 가장 비싸다.
국내 유전자 치료제 개발업계 관계자는 “희귀 질환 환자를 위한 신약의 필요성이라는 측면도 중요하지만, 유럽 연합(EU)과 미국에서 유전자 치료제 승인에 대한 경쟁이 펼쳐지고 있는 상황이다”며 “출시 자체가 새로운 시장을 개척하는 부분이 있기 때문에, ‘최초’라는 타이틀을 앞다퉈 가져가려는 것이다. 향후 몇 년간 관련 신약의 등장이 증가할 것”이라고 내다봤다.
|
올해 유럽 내 가장 많은 신약을 배출한 제약사는 사노피다. 회사는 단독 개발(1종) 및 공동개발(3종) 등을 통해 총 4종의 신약을 배출했다.
앞서 언급한 카빅티와 외에 사노피는 코로나19 부스터샷 백신인 ‘비드프레브틴 베타’와 RSV 감염 예방 백신 ‘베이포투스’를 각각 영국 글락소스미스클라인(GSK) 및 아스트라제네카(AZ)와 함께 개발해 유럽에서 승인받는 데 성공했다.
또 회사는 지난 7월 EMA로부터 ‘스핑고 미엘린 분해효소 결핍증’(ASMD) 대상 최초의 치료제인 ‘젠포짐’(성분명 올리푸다이즈 알파)의 품목허가를 획득했다. ASMD는 일명 니만-피크병으로 불리며, 콜레스테롤 대사에 관여하는 NPC1 유전자의 돌연변이로 지질이 축적돼 문제를 일으키는 희귀 퇴행성 뇌질환으로 알려졌다.
가장 최근인 지난 21일(현지시간) EMA는 스웨덴 오르판 비오비트룸과 스위스 ADC 체라퓨틱스가 개발한 항체약물접합(ADC) 신약 ‘진론타’(성분명 론카스툭시맙 테시린)를 조건부 허가했다. 진론타는 2회 이상 전신요법제를 사용한 성인 재발성 또는 불응성 미만성 거대 B세포종 환자 대상 3차 치료제이며, 지난해 4월 미국에서 가속승인돼기도 했다.
이밖에도 EMA는 올 한해 동안 △각종 코로나19백신 및 원숭이두창 백신(이부실드)에 대해 적응증 확대(8건) △대표 코로나 19백신(누박소비드, 스파이크백스)을 조건부에서 일반 허가로 조건 변경(1건), 난소암 대상 3차치료제 ‘루브라카’ 허가취하 결정(1건) 등 인체 적용 의약품에 대한 10건의 주요 심의 결과를 공표하기도 했다.
한편 국내 식약처는 지난 6월 제35호 국산 신약으로 SK바이오사이언스(302440) 코로나19 백신 ‘스카이코비원’을 승인했다. 지난달에는 대웅제약의 2형 당뇨병 치료제 ‘엔블로’(성분명 이나보글리플로진)가 제36호 신약으로 품목허가됐다. 엔블로는 국내사가 자체 개발한 최초의 SGLT-2 계열의 당뇨병 치료제로 이름을 올렸다.
올해 국내사가 개발한 신약은 단 2종에 그친 셈이다. 하지만 지난 19일 기준 제네릭(복제약)이나 해외 기승인 약물 도입 등을 포함하면 국내에서 누적 승인된 의약품은 총 641종에 이른 것으로 집계됐다.





![여수산단은 좀비 상태...못살리면 한국 산업 무너진다[only 이데일리]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/03/PS26031201409t.jpg)



![가정집서 나온 백골 시신...'엽기 부부' 손에 죽은 20대였다 [그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/03/PS26031300001t.jpg)