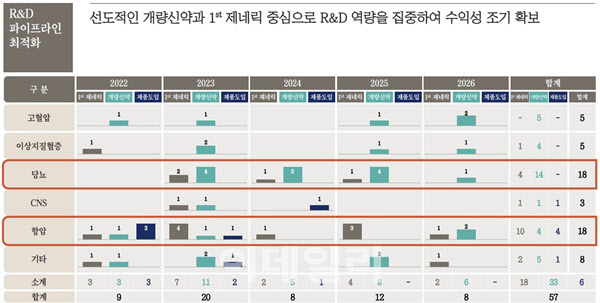
13일 제약·바이오 업계에 따르면 보령은 내년 퍼스트 제네릭과 개량신약, 국내 판권 인수 품목을 합쳐 모두 20개 제품을 출시할 예정이다. 퍼스트 제네릭 7개, 개량신약 11개, 제품 도입 2개로 이뤄진다. 내년 예상 출시 품목은 보령이 2026년까지 계획한 출시 규모 중 가장 크다. 회사는 2026년까지 모두 57개 품목을 도입한다는 목표다.
|
보령 관계자는 “현금 창출 능력을 확보하는 게 주요 목표”이라며 “시장에 빠르게 침투할 수 있는 개량신약과 제네릭을 개발해 우리 제품들을 최대한 많이 만들어 내는 방식으로 수익성을 높일 계획이다”라고 말했다.
보령은 전문의약품 매출이 전체의 80%를 차지할 만큼 포트폴리오 대부분이 전문의약품 중심으로 구축돼 있다. 고혈압과 이상지질혈증, 당뇨, CNS(중추신경계) 등 5대 만성질환과 관련한 의약품이 대부분이다. 회사는 ‘자가 제품력 강화’를 중장기 경영방침으로 정하고, 2026년까지 자가 제품 비중을 70% 수준으로 끌어올린다는 계획이다. 특히 내년에는 국내 독점 판권을 확보한 주요 제품들 출시가 예정돼 있어 실적 기대감을 키우고 있다.
대표 품목이 내년 초 도입 예정인 소세포폐암(SCLC) 치료제 ‘젭젤카주’다. 최근 식품의약품안전처는 젭젤카에 대한 안전성과 유효성 심사를 마쳤다. 다른 변수가 없다면 조만간 허가를 받을 가능성이 높다는 분석이 나온다. 젭젤카는 보령이 국내 개발·판매에 대한 독점권한을 보유하고 있는 항암제다. 회사는 지난 2017년 스페인 파마마와 젭젤카 기술도입 계약을 맺고 2020년 6월 미국 식품의약국(FDA)으로부터 판매허가를 획득한 후 국내 도입 시기를 조율해왔다. 소세포폐암은 비소세포폐암보다 진행 속도가 빠르고 재발률이 높은 것으로 알려져 새 치료제 필요성이 높은 상황이다.
이와 함께 보령이 국내 판권을 보유한 뿌리는 탈모약 ‘핀쥬베’도 내년 초 출시될 예정이다. 식약처는 지난 6일 보령의 ‘핀쥬베스프레이’ 품목허가를 승인했다. 다국적 제약사 알미랄이 개발한 핀쥬베는 세계 최초 ‘피나스테리드’ 성분의 뿌리는 탈모약이다. 이탈리아, 독일, 룩셈부르크, 포르투갈 등에서 출시 허가를 받았다. 보령에 따르면 해외 임상시험 결과 핀쥬베는 경구용 피나스테리드 1㎎와 동등한 수준의 효능을 나타냈다. 또 경구용 피나스테리드 대비 100분의 1 수준의 혈중농도를 보여 인체에 미치는 영향이 적은 것으로 나타났다.
보령 관계자는 “핀쥬베는 경구용 피나스테리드 1mg의 효능은 그대로 유지하되, 탈모 부위 두피를 대상으로 직접 분무되는 방식이기 때문에 신체에 미치는 영향을 최소화하고자 한 제품”이라며 “경구용 탈모약에 대한 안드로겐성 탈모증 환자들에게 좋은 치료 옵션이 될 수 있어 시장 기대감이 큰 상황”이라고 말했다.




![여수산단은 좀비 상태...못살리면 한국 산업 무너진다[only 이데일리]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/03/PS26031201409t.jpg)



![가정집서 나온 백골 시신...'엽기 부부' 손에 죽은 20대였다 [그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/03/PS26031300001t.jpg)