|
돼지심장 이식 후 사망 이유?…‘바이러스 감염’ vs. ‘약물로 인한 심정지’
11일 업계에서는 이종 간 장기이식의 임상과 연구가 활발해질 수 있다는 분석이 나오고 있다. 지난달 30일(현지시간) 월스트리트저널(WSJ)이 FDA가 돼지 장기 이식과 관련된 임상을 허용하기 위해 세부 논의가 이뤄지고 있다고 보도했다.
WSJ는 돼지 심장을 사람에게 이식하는 내용으로 미국 메릴랜드대 연구진이 명확한 지침을 마련해 줄 것을 FDA에 요청했고, 이 제안에 대응하기 위한 계획을 곧 발표할 것이라고 전했다.
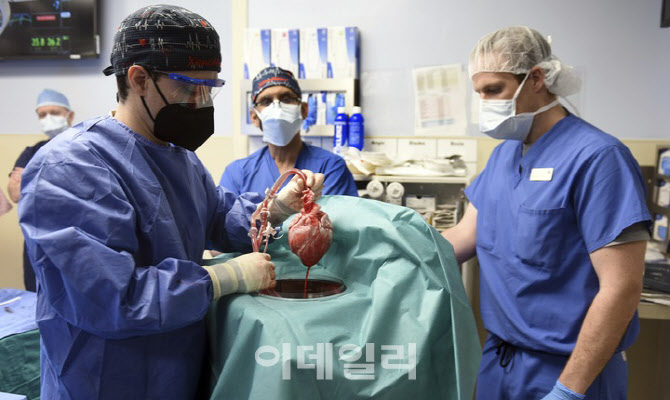
메릴랜드대는 지난 1월 세계 최초로 심장병 환자 데이비드 베넷(57세)에게 형질전환돼지의 심장을 이식한 바 있다. 당시에는 명확한 임상 지침이 마련되지 않은 상황에서 환자와 의료진의 요청에 의해 FDA가 수술 진행을 허락했던 것으로 알려졌다.
하지만 베넷은 2개월 뒤인 3월 사망했다. 이에 대해 처음에는 돼지에서 옮겨진 돼지거대세포바이러스(PCMV) 감염이 사망원인으로 꼽혔지만, 최근 들어 약물로 인한 심정지라는 결론이 제기되는 상황이다,
지난 5월 독일 베를린대 연구진은 국제학술지 ‘테크놀러지 리뷰’에 실은 논문을 통해 “심장을 제공한 돼지의 입 부위에서 PCMV 검사를 했지만, 조직 깊이 숨은 바이러스를 검출하지 못했 던 것”이라며 더 정확한 검사의 필요성을 제기했다.
그런데 지난 6일(현지시간) 미국 일간 워싱턴포스트 등은 메릴랜드대 의료진이 베넷의 사인에 대해 감염 또는 면역 거부를 목적으로 투여한 약물로 인한 심정지라는 결론을 내렸다고 보도했다. 이식 후 심장이 두꺼워졌다가 경직된 흔적으로 볼 때 특정 약물에 대한 반응 때문에 혈액 순환에 문제가 발생했다는 것이다.
이처럼 새롭게 시도되는 이종장기 이식이 가져올 전염병 위험 및 면역거부 반응 억제를 위한 약물 투여량 등 관련 지침 마련이 시급한 상황이지만, 처음으로 시도되는 일인 만큼 쉬운 일이 아니다. 그럼에도 FDA가 지난달 29일 이종이식 과정 내 면역거부반응, 바이러스 검사 등 잠재적 규제 요건을 논의 중인 것으로 확인됐고, WSJ가 관련 지침 마련이 급물살을 탈 것이란 전망을 내놓았다.
|
이종 췌도 이식에 도전하는 제넨바이오, 옵티팜…“국내 지침 논의도 활발”
국내 식품의약품안전처(식약처)도 당뇨병의 근본적인 치료를 위한 돼지 췌도 세포를 사람에게 이식하는 제넨바이오의 임상 1상 시험계획(IND)을 심사하는 중이다. 식약처가 해당 IND를 승인한다면, 제넨바이오는 세계 최초로 이종간 췌도 이식 임상을 시도하게 된다.
제넨바이오는 이번 IND를 2020년 최초로 식약처에 신청한 바 있다. 그런데 식약처가 최종심사 기일(지난해 8월) 전까지 추가 보완자료를 요청했다. 회사 측을 보완자료 제출기일을 맞추지 못할 것으로 판단하고 IND를 자진철회한 뒤, 2021년 8월 말에 재신청했다.
제넨바이오 관계자는 “무균 환경에서 키운 ‘무균돼지’의 세포를 설치류에 이식 후 1개월간 안전성을 관찰한 데이터를 첨부했었다”며 “그런데 식약처가 이식 후 1년 가량 장기 추적한 안전성 데이터를 추가로 요구했다”고 설명했다. 이어 “쥐 등 설치류의 생의 주기로 볼 때 1년은 상당히 길다. 식약처와 여러 번 논의해 6개월 정도 관찰한 자료를 마련했다”고 말했다.
제넨바이오 측은 오는 18일 식약처가 요청한 임상 IND 관련 장기 추적 데이터를 제출할 예정이다. 회사 관계자는 “최근 FDA에서 이종장기 이식 관련 회의와 지침 마련을 위한 논의가 긍정적으로 흘러가고 있다는 보도와 우리의 임상 재개 가능성에 대한 기대가 맞물려, 주가가 크게 올랐다”며 “관련 기대에 부응하기 위해 보완자료를 마무리하고 있다”고 설명했다. 실제로 지난 8일 이 회사 주가는 상한가를 기록했다.
그는 “돼지에서 알려진 140여 가지 이상의 진균이나 바이러스를 검사하기 위해 조직을 채취해 유전자 증폭하는 등 각각의 오염원이 없다는 보고서를 마련했다”며 “무균 환경에서 키운 돼지와 이후 검사를 통해 감염 위험을 최소화하는 방안을 강화하고 있다”고 덧붙였다.
한편 옵티팜은 형질전환돼지의 췌도를 활용한 이종 췌도 이식 연구를 진행하고 있다. 지난달 회사는 미국 엑소스템과 관련 비임상 공동연구 계약도 체결했다. 이식할 췌도 세포를 엑소좀으로 이중 코팅하는 등 여러 방법으로 치료 개선 효과를 측정하려는 중이다.
옵티팜 관계자는 “엑소좀으로 돼지세포를 이중코팅해 면역 거부반응을 최소화할 수 있을지 연구를 하려는 것”이라며 “바이러스 오염관련해서는 식약처와 이종장기 관련 업계가 ‘완전한 무균환경 시설(DPF)’의 지침을 논의하고 있다. 식약처에 지침에 맞춘 무균환경 시설을 짓고, 무균 형질전환돼지로 병원성 물질 오염 문제를 최소화해 나가겠다”고 말했다.

![조상님도 물가 아시겠죠… 며느리가 밀키트 주문한 이유[사(Buy)는 게 뭔지]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26021500087t.jpg)

![설에 선물한 상품권, 세금폭탄으로 돌아온 까닭은?[세상만사]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26021500108t.jpg)
!['36.8억' 박재범이 부모님과 사는 강남 아파트는[누구집]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26021500062t.jpg)
