|
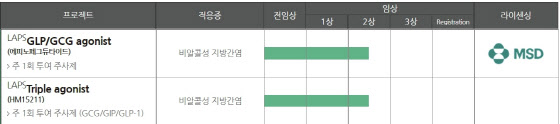
9일 미국국립보건원(NIH) 임상시험 정보사이트 ‘클리니컬 트라이얼’에 따르면 지난달 19일 한미약품의 듀얼 아고니스트 기전 NASH 치료제 후보물질(옛 코드명 HM12525A)의 임상 2a상이 종료됐다. 지난 2020년 한미약품으로부터 HM12525A(성분명 에피노페그듀타이드)를 기술이전해 간 미국 머크(MSD)는 이 같은 내용을 지난 2일 클리니컬 트라이얼에 게시했다. 145명의 환자를 대상으로 하는 임상 2a상의 1차 유효성 평가지표는 독립맹검심사위원회(BICR)가 24주 후 MRI-PDFF(자기공명영상-양자밀도 지방비율) 검사를 이용해 측정한 평균 LFC 상대감소율과 이상반응 발생건수, 이상반응에 의한 임상중단건수 등이다. 증권업계에선 내년 상반기 중 임상 2a상 결과 발표, 내년 하반기 중 임상 2b상 개시를 예상하고 있다.
한미약품은 HM12525A 외 직접 임상 2b상을 진행 중인 트리플 아고니스트 기전 NASH 치료제 후보물질 ‘HM15211’(성분명 에포시페그트루타이드)도 보유하고 있다. HM15211 역시 내년 상반기 중 중간데이터가 공개될 것으로 점쳐진다. HM15211는 HM12525A에 비해 전임상 데이터가 좋게 나오면서 시장의 기대감이 더 컸다. 애초 예정된 첫 환자 평가데이터 도출 시점이 지난 9월이었기 때문에 연내 한미약품이 굵직한 기술이전 성과를 내는 것 아니냐는 전망도 나왔다. 하지만 임상 일정이 늦춰지면서 HM12525A와 함께 내년 상반기에 2b상에 대한 중간 결과를 받아볼 전망이다. 기술이전 성과 도출이 기대되는 시점도 내년 상반기로 미뤄졌다.
한미약품 관계자는 “코로나19 탓에 전체적인 HM15211의 임상 시험 시점이 연장됐다”며 “현재 중간분석은 순조롭게 진행되고 있어 결과가 도출되는 시점에 신속히 공개할 예정”이라고 설명했다. 클리니컬 트라이얼에 게시된 내용에 따르면 HM15211의 임상 2b상 종료 시점은 2024년 11월에서 2025년 11월로 1년 연장됐다.
|
HK이노엔은 내년 상반기 중 NASH 치료제 임상 2상 성적표를 기다리는 또 다른 기업이다. HK이노엔은 국내 바이오 기업 퓨쳐메디슨과 헝가리, 폴란드, 스페인에서 지난해 6월부터 임상을 진행 중이다. 총 60명의 환자를 대상으로 안전성과 유효성을 평가해 내년 5월31일 중간발표, 같은 해 8월31일 2상을 종료하는 것을 목표로 한다.
앞서 글로벌 제약사들은 2상에서 좋은 결과를 받아들고도 3상에서 실패해 이제까지 품목허가를 받지 못했다. 지난달 초 미국 인터셉트 파마슈티컬스의 ‘오베티콜릭산’이 임상 3상에서 유효성 입증에 실패하면서 재도전에서 다시 한번 고배를 마셨다. 길리어드사이언스의 ‘셀론설팁’도 FDA의 허가 문턱에서 좌절했다. 화이자도 지난 7월 ‘GLP-1’ 기반의 NASH 치료제 후보물질인 ‘PF-06882961’의 개발 종료를 발표했다.
업계에서는 만성질환이라는 특성상 임상 2상 결과가 좋게 나오더라도 미국 식품의약품안전처(FDA)의 조건부 허가를 받을 확률은 낮을 것으로 본다. 대신 시장성이 크기 때문에 가능성 있는 신규 후보물질에 대한 글로벌 빅파마들의 기술이전 수요는 높다. 한 바이오 전문 애널리스트는 “글로벌 제약사들은 누가 NASH 치료제 혁신신약을 먼저 만드느냐를 두고 치열하게 겨루고 있다”며 “내년 상반기 임상 2상 성적표가 좋게 나온다면 굵직한 기술이전 성과를 기대해 볼 수 있다”고 말했다.
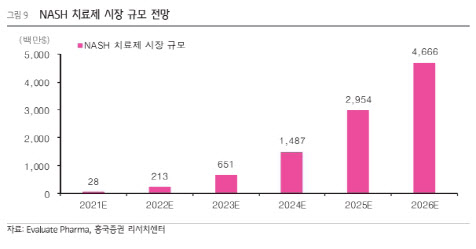
NASH는 알코올 섭취와 무관하게 간 조직에 지방이 축적되고 만성 염증, 간 섬유화가 나타나는 비알코올성단순지방간(NAFL)의 진행성 질환이다. NASH로 간 기능 손상이 심해지면 간 경변, 간암으로 악화될 수 있다. 글로벌 의약품 시장조사기업 이밸류에이트 파마에 따르면 올해 NASH 치료제 시장 규모는 2억1300만달러(한화 약 2894억원)로 예상되며 오는 2026년까지 20배 이상 성장해 46억6600만달러(6조3388억원)에 육박할 전망이다.